
題目列表(包括答案和解析)
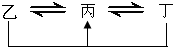 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序數依次增大.其中 D、F為常見金屬元素;A元素原子核內只有一個質子,元素A與B形成的氣態化合物甲在標準狀況下的密度為0.759g?L-1,C元素原子的最外層電子數是其電子層數的3倍,E與C同主族,由D或F元素組成的單質或某些離子(或化合物)在溶液中均有下列轉化關系(其它參與反應的物質未列出):其中,均含D元素的乙、丙、丁微粒間的轉化全為非氧化還原反應;均含F元素的乙、丙、丁微粒間的轉化全為氧化還原反應;相鄰的乙與丙或丙與丁兩兩間均互不發生化學反應.請回答下列問題:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序數依次增大.其中 D、F為常見金屬元素;A元素原子核內只有一個質子,元素A與B形成的氣態化合物甲在標準狀況下的密度為0.759g?L-1,C元素原子的最外層電子數是其電子層數的3倍,E與C同主族,由D或F元素組成的單質或某些離子(或化合物)在溶液中均有下列轉化關系(其它參與反應的物質未列出):其中,均含D元素的乙、丙、丁微粒間的轉化全為非氧化還原反應;均含F元素的乙、丙、丁微粒間的轉化全為氧化還原反應;相鄰的乙與丙或丙與丁兩兩間均互不發生化學反應.請回答下列問題:

(本題共12分)鉻鐵礦的主要成分可表示為FeO·Cr2O3,還含有MgO、Al2O3、Fe2O3等雜質,以下是以鉻鐵礦為原料制備重鉻酸鉀(K2Cr2O7)的流程圖:
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O28Na2CrO4+ 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O32NaAlO2+ CO2↑;③ Cr2O72-+ H2O
2CrO42- + 2H+
根據題意回答下列問題:
1.固體X中主要含有_________(填寫化學式);要檢測酸化操作中溶液的pH是否等于4.5,應該使用__________(填寫儀器或試劑名稱)。
2.酸化步驟用醋酸調節溶液pH<5,其目的是_________________________________。
3.操作Ⅲ有多步組成,獲得K2Cr2O7晶體的操作依次是:加入KCl固體、蒸發濃縮、 、過濾、_______、干燥。
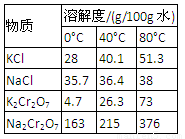
4.下表是相關物質的溶解度數據,操作Ⅲ發生反應的化學方程式是:Na2Cr2O7+2KCl → K2Cr2O7↓+2NaCl。該反應在溶液中能發生的理由是_______________。
5.副產品Y主要含氫氧化鋁,還含少量鎂、鐵的難溶化合物及可溶性雜質,精確分析Y中氫氧化鋁含量的方法是稱取n g樣品,加入過量______(填寫試劑)、溶解、過濾、再______(填寫試劑)、……灼燒、冷卻、稱量,得干燥固體m g 。計算樣品中氫氧化鋁的質量分數為_________(用含m、n的代數式表示)。
6.六價鉻有毒,而Cr3+相對安全。工業含鉻(CrO3)廢渣無害化處理的方法之一是干法解毒,用煤不完全燃燒生成的CO還原CrO3。在實驗室中模擬這一過程的裝置如下:
CO由甲酸脫水制得;實驗結束時熄滅酒精燈的順序是_________________________。
(本題共12分)鉻鐵礦的主要成分可表示為FeO·Cr2O3,還含有MgO、Al2O3、Fe2O3等雜質,以下是以鉻鐵礦為原料制備重鉻酸鉀(K2Cr2O7)的流程圖:
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+
根據題意回答下列問題:
1.固體X中主要含有_________(填寫化學式);要檢測酸化操作中溶液的pH是否等于4.5,應該使用__________(填寫儀器或試劑名稱)。
2.酸化步驟用醋酸調節溶液pH<5,其目的是_________________________________。
3.操作Ⅲ有多步組成,獲得K2Cr2O7晶體的操作依次是:加入KCl固體、蒸發濃縮、 、過濾、_______、干燥。
4.下表是相關物質的溶解度數據,操作Ⅲ發生反應的化學方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。該反應在溶液中能發生的理由是_______________。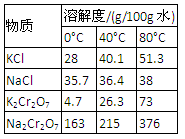
5.副產品Y主要含氫氧化鋁,還含少量鎂、鐵的難溶化合物及可溶性雜質,精確分析Y中氫氧化鋁含量的方法是稱取n g樣品,加入過量______(填寫試劑)、溶解、過濾、再______(填寫試劑)、……灼燒、冷卻、稱量,得干燥固體m g 。計算樣品中氫氧化鋁的質量分數為_________(用含m、n的代數式表示)。
6.六價鉻有毒,而Cr3+相對安全。工業含鉻(CrO3)廢渣無害化處理的方法之一是干法解毒,用煤不完全燃燒生成的CO還原CrO3。在實驗室中模擬這一過程的裝置如下: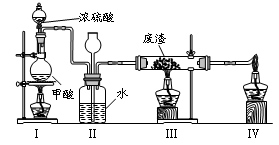
CO由甲酸脫水制得;實驗結束時熄滅酒精燈的順序是_________________________。
(本題共12分)鉻鐵礦的主要成分可表示為FeO·Cr2O3,還含有MgO、Al2O3、Fe2O3等雜質,以下是以鉻鐵礦為原料制備重鉻酸鉀(K2Cr2O7)的流程圖:
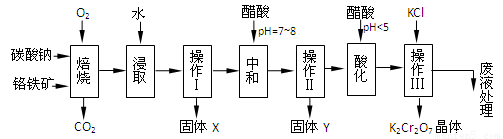
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O
2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根據題意回答下列問題:
1.固體X中主要含有_________(填寫化學式);要檢測酸化操作中溶液的pH是否等于4.5,應該使用__________(填寫儀器或試劑名稱)。
2.酸化步驟用醋酸調節溶液pH<5,其目的是_________________________________。
3.操作Ⅲ有多步組成,獲得K2Cr2O7晶體的操作依次是:加入KCl固體、蒸發濃縮、 、過濾、_______、干燥。
4.下表是相關物質的溶解度數據,操作Ⅲ發生反應的化學方程式是:Na2Cr2O7+2KCl → K2Cr2O7↓+2NaCl。該反應在溶液中能發生的理由是_______________。
5.副產品Y主要含氫氧化鋁,還含少量鎂、鐵的難溶化合物及可溶性雜質,精確分析Y中氫氧化鋁含量的方法是稱取n g樣品,加入過量______(填寫試劑)、溶解、過濾、再______(填寫試劑)、……灼燒、冷卻、稱量,得干燥固體m g 。計算樣品中氫氧化鋁的質量分數為_________(用含m、n的代數式表示)。
6.六價鉻有毒,而Cr3+相對安全。工業含鉻(CrO3)廢渣無害化處理的方法之一是干法解毒,用煤不完全燃燒生成的CO還原CrO3。在實驗室中模擬這一過程的裝置如下:
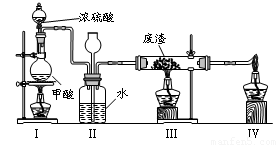
CO由甲酸脫水制得;實驗結束時熄滅酒精燈的順序是_________________________。
(9分)A、B、C、D是中學化學中常見的四種化合物,它們分別由兩種元素組成.甲、乙、丙是單質,甲、丙、A、C、D常溫下均為氣體,B為液體.這些單質和化合物之間存在如下關系:
(1)寫出下列物質的分子式:A_______ 甲_______、丙_______.
(2)寫出單質甲跟化合物C反應,生成SO2和化合物B的化學方程式_____________.
(3)標準狀況下將28L化合物A與足量的過氧化鈉充分反應轉移電子的數目為
(4)在密閉容器中,化合物B跟化合物D在高溫下生成化合物A和單質丙的反應是可逆反應,其化學方程式為__________。
(5)化合物C的穩定性比化合物B (填強或弱)。
【解析】本題屬于無機框圖題,關鍵是尋找突破點。常見的液體是水,則B是水。單質和化合物反應生成SO2和水的反應,根據原子守恒可知甲應是氧氣,C是H2S。單質和氣態化合物反應生成另外一種氣態化合物的,常見的是CO2和C的反應生成CO,因此A是CO2,D是CO,乙是C。CO在高溫下和水蒸氣反應又生成CO2和氫氣,所以丙是氫氣。
(1)(2)(4)略
(3)28LCO2的物質的量是![]() 。CO2和過氧化鈉反應的方程式為2CO2+2Na2O2=2Na2CO3+O2↑,在反應中過氧化鈉既是氧化劑也是還原劑,轉移的電子是2,所以當消耗1.25mol是轉移的電子數目為1.25NA。
。CO2和過氧化鈉反應的方程式為2CO2+2Na2O2=2Na2CO3+O2↑,在反應中過氧化鈉既是氧化劑也是還原劑,轉移的電子是2,所以當消耗1.25mol是轉移的電子數目為1.25NA。
(5)S的非金屬性弱于O的,所以H2S的穩定性弱于H2O的。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com