
題目列表(包括答案和解析)
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 現象 |
| ① | 第一份CuSO4溶液 | a | 溶液由藍色變為藍綠色 |
| ② | 第一份CuSO4溶液 | b | 溶液由藍色變為草綠色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由藍色變為亮綠色 |
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 現象 |
| ① | d | 第一份NaBr溶液 | 溶液由藍色變為藍綠色 |
| ② | e | 第一份NaBr溶液 | 溶液由藍色變為草綠色 |
| ③ | f | 第一份NaBr溶液 | 溶液由藍色變為亮綠色 |
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 溫度 | 現象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由藍色變為藍綠色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由藍色變為草綠色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由藍色變為亮綠色 |
在化學的發展史上,世界上許多科學家創建的理論對化學科學的發展起到重大的作用。下 列有關科學家及其創建的理論的描述中,錯誤的是( )
A.門捷列夫發現了元素周期律 B.道爾頓創立分子學說
C.拉瓦錫確立了質量守恒定律 D.勒沙特列發現化學平衡移動原理
(12分)現在普遍應用的工業合成氨的方法是哈伯于1905年發明的,但此法反應物的轉化率不高。
(1)已知1 mol N2(g)與適量H2(g)完全反應,當生成NH3(g)0.1mol時,放出9.22kJ熱量,寫出反應的熱化學方程式: 。
(2)若該反應在298K、398K時的化學平衡常數分別為K1、K2,則K1 K2(填“>” “=” 或 “<” )。
(3)在一定溫度下,向容積不變(始終為10L)的密閉容器中加入2 mol N2、8 mol H2 及固體催化劑。10分鐘后反應達到平衡狀態,容器內氣體壓強變為起始的80%,此時氨氣的體積分數為 ,用氮氣表示的反應速率: 。若想提高氨氣的產率,根據化學平衡移動原理,請提出合理的建議: (任意寫一條)。
(4)在上述相同條件下,若起始時加入4 mol NH3、2 mol H2及固體催化劑,反應達到平衡時NH3的體積分數比(3)中 (填“大”、“小”或“相等”)。
(5)隨著對合成氨研究的發展,2001年兩位希臘化學家提出了電解合成氨的方法,即在常壓下把氫氣和用氦氣稀釋的氮氣,分別通入一個加熱到570℃的電解池中,采用高質子導電性的SCY陶瓷(能傳遞H+)為介質,用吸附在它內外表面上的金屬鈀多晶薄膜做電極,實現了常壓、570℃條件下高轉化率的電解法合成氨(裝置如右圖)。在電解法合成氨的電解池中 (填“能”或“不能”) 用水作電解質溶液的溶劑,原因是 。
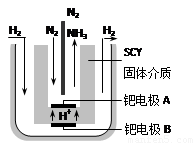
鈀電極A是電解池的 極(填“陽”或“陰”),該極上的電極反應式是 。
(12分)現在普遍應用的工業合成氨的方法是哈伯于1905年發明的,但此法反應物的轉化率不高。
(1)已知1 mol N2(g)與適量H2(g)完全反應,當生成NH3(g)0.1mol時,放出9.22kJ熱量,寫出反應的熱化學方程式: 。
(2)若該反應在298K、398K時的化學平衡常數分別為K1、K2,則K1 K2(填“>” “="”" 或 “<” )。
(3)在一定溫度下,向容積不變(始終為10L)的密閉容器中加入2 mol N2、8 mol H2 及固體催化劑。10分鐘后反應達到平衡狀態,容器內氣體壓強變為起始的80%,此時氨氣的體積分數為 ,用氮氣表示的反應速率: 。若想提高氨氣的產率,根據化學平衡移動原理,請提出合理的建議: (任意寫一條)。
(4)在上述相同條件下,若起始時加入4 mol NH3、2 mol H2及固體催化劑,反應達到平衡時NH3的體積分數比(3)中 (填“大”、“小”或“相等”)。
(5)隨著對合成氨研究的發展,2001年兩位希臘化學家提出了電解合成氨的方法,即在常壓下把氫氣和用氦氣稀釋的氮氣,分別通入一個加熱到570℃的電解池中,采用高質子導電性的SCY陶瓷(能傳遞H+)為介質,用吸附在它內外表面上的金屬鈀多晶薄膜做電極,實現了常壓、570℃條件下高轉化率的電解法合成氨(裝置如右圖)。在電解法合成氨的電解池中 (填“能”或“不能”) 用水作電解質溶液的溶劑,原因是 。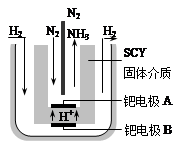
鈀電極A是電解池的 極(填“陽”或“陰”),該極上的電極反應式是 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com