
題目列表(包括答案和解析)
| 時間(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
80℃時,將0.40mol的N2O4氣體充入2 L已經抽空的固定容積的密閉容器中,發生如下反應:N2O4 ![]() 2NO2,△H>0隔一段時間對該容器內的物質進行分析,得到如下數據:
2NO2,△H>0隔一段時間對該容器內的物質進行分析,得到如下數據:
| 時間(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| N(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)計算20s—40s內用N2O4表示的平均反應速率為 mol·L-1·s-1
(2)計算在80℃時該反應的平衡常數K= ;
(3)要增大該反應的K值,可采取的措施有(填序號) ;
A.增大N2O4的起始濃度 B.向混合氣體中通入NO2
C.使用高效催化劑 D.升高溫度
(4)如右圖是80℃時容器中N2O4物質的量的變化曲線,請在該圖中補畫出該反應在60℃時N2O4物質的量的變化曲線。
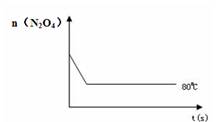
80℃時,將0.40mol的N2O4氣體充入2 L已經抽空的固定容積的密閉容器中,發生如下反應:N2O42NO2,△H>0隔一段時間對該容器內的物質進行分析,得到如下數據:
| 時間(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| N(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)計算20s—40s內用N2O4表示的平均反應速率為 mol·L-1·s-1
(2)計算在80℃時該反應的平衡常數K= ;
(3)要增大該反應的K值,可采取的措施有(填序號) ;
A.增大N2O4的起始濃度 B.向混合氣體中通入NO2
C.使用高效催化劑 D.升高溫度
(4)如右圖是80℃時容器中N2O4物質的量的變化曲線,請在該圖中補畫出該反應在60℃時N2O4物質的量的變化曲線。
(8分)80℃時,將0.40mol的N2O4氣體充入2L已經抽空的固定容積的密閉容器中,發生如下反應:N2O4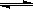 2NO2 △H>0,隔一段時間對該容器內的物質進行分析,得到如下數據:
2NO2 △H>0,隔一段時間對該容器內的物質進行分析,得到如下數據:
| 時間(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
Ⅰ.恒溫,容積為1
L恒容條件下,硫可以發生如下轉化,其反應過程和能量關系如圖1所示(已知:2SO2(g)+O2(g)  2SO3(g)
ΔH=-196.6 kJ·mol-1),請回答下列問題:
2SO3(g)
ΔH=-196.6 kJ·mol-1),請回答下列問題:
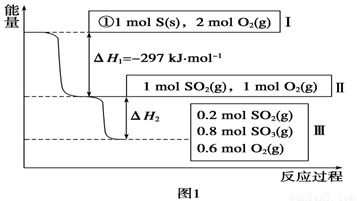
(1)寫出能表示硫的燃燒熱的熱化學方程式:______________________。
(2)ΔH2=__________kJ·mol-1。
Ⅱ.工業上常利用醋酸和乙醇合成有機溶劑乙酸乙酯:
CH3COOH(l)+C2H5OH(l)
 CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-8.62 kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸點依次為118 ℃、78 ℃和77 ℃。在其他條件相同時,某研究小組進行了多次實驗,實驗結果如圖所示。
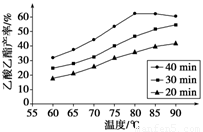
(1)該研究小組的實驗目的是___________________________________。
(2)60 ℃下反應40 min與70 ℃下反應20 min相比,前者的平均反應速率________后者(填“小于”、“等于”或“大于”)。
(3)如圖所示,反應時間為40 min、溫度超過80 ℃時,乙酸乙酯產率下降的原因可能是_________________________________(寫出兩條)。
Ⅲ.煤化工中常需研究不同溫度下平衡常數、投料比及熱值等問題。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常數隨溫度的變化如下表:
H2(g)+CO2(g)平衡常數隨溫度的變化如下表:
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數K |
9.94 |
9 |
1 |
試回答下列問題:
(1)在800 ℃發生上述反應,以表中的物質的量投入恒容反應器,其中向正反應方向移動的有________(選填“A、B、C、D、E”)。
n(CO) n(H2O) n(H2) n(CO2)
A 1 5 2 3
B 2 2 1 1
C 3 3 0 0
D 0.5 2 1 1
E 3 1 2 1
(2)已知在一定溫度下,C(s)+CO2(g)  2CO(g)平衡常數為K;
2CO(g)平衡常數為K;
①C(s)+H2O(g)  CO(g)+H2(g) 平衡常數為K1;
CO(g)+H2(g) 平衡常數為K1;
②CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常數為K2;
H2(g)+CO2(g) 平衡常數為K2;
則K、K1、K2之間的關系是______________________________________。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com