
題目列表(包括答案和解析)
兩種興奮劑的結構分別為:
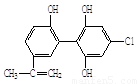
興奮劑X 興奮劑Y
則關于它們的說法中正確的是
A.兩種興奮劑遇FeCl3溶液均顯色,均屬于苯酚的同系物
B.興奮劑Y 不能發生取代反應
C.1 mol興奮劑X與足量濃溴水反應,可以消耗4 mol Br2
D.興奮劑X所有碳原子不可能共平面
兩種興奮劑的結構分別為:
興奮劑X 興奮劑Y
則關于它們的說法中正確的是
A.兩種興奮劑遇FeCl3溶液均顯色,均屬于苯酚的同系物
B.興奮劑Y 不能發生取代反應
C.1 mol興奮劑X與足量濃溴水反應,可以消耗4 mol Br2
D.興奮劑X所有碳原子不可能共平面
(6分)在一定條件下進行如下反應:aX(g)+bY(g) cZ(g),如圖是不同溫度下反應達到平衡時,反應混合物中Z的體積分數和壓強的關系示意圖。
cZ(g),如圖是不同溫度下反應達到平衡時,反應混合物中Z的體積分數和壓強的關系示意圖。
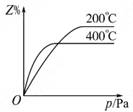
(1)寫出該反應的化學平衡常數表達式:K= 。隨著溫度的升高,K值 (填”增大”“減小”或”不變”)。當反應物起始濃度相同時,平衡常數K值越大,表明 (填序號)。
A.X的轉化率越高 B.反應進行得越完全
C.達到平衡時X的濃度越大 D.化學反應速率越快
(2)如圖所示,相同溫度下,在甲、乙兩容器中各投入1 mol X、2 mol Y和適量催化劑,甲、乙兩容器的初始體積均為1 L。甲、乙容器達到平衡所用時間:甲 乙(填”>““<“或”=“,下同),平衡時X和Y的轉化率:甲 乙。
(6分)在一定條件下進行如下反應:aX(g)+bY(g) cZ(g),如圖是不同溫度下反應達到平衡時,反應混合物中Z的體積分數和壓強的關系示意圖。
cZ(g),如圖是不同溫度下反應達到平衡時,反應混合物中Z的體積分數和壓強的關系示意圖。
(1)寫出該反應的化學平衡常數表達式:K= 。隨著溫度的升高,K值 (填”增大”“減小”或”不變”)。當反應物起始濃度相同時,平衡常數K值越大,表明 (填序號)。
| A.X的轉化率越高 | B.反應進行得越完全 |
| C.達到平衡時X的濃度越大 | D.化學反應速率越快 |
已知可逆反應X(g)+2Y(g)![]() Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4 mol Y和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法正確的是
Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4 mol Y和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法正確的是
A.a點正反應速率大于逆反應速率
B.增大X的濃度,X的轉化率增大
C.容器中壓強恒定時,不能說明反應已達平衡狀態
D.保持溫度和密閉容器的壓強不變,再充入1 mol X和2 mol Y,再次達到平衡時n(Z)/n(X)的值會變小

一、選擇題(本題包括9小題,每小題3分,共27分,每小題只有一個選項符合題意)
1. B 2.A 3.C 4.B 5.B 6.D 7.B 8.D 9. C
二、選擇題(本題9小題,每小題4分,共36分。每小題有一個或兩個選項符合題意)
10.AD 11.C 12.BC 13.D 14.AC 15.AD 16.A D 17.C 18.D
三、本題包括3小題,共34分)
19.(11分)NaCl+NH3+CO2+H2O = NaHCO3↓+NH4Cl(1分)
(1) 漏斗中與試管中的液面差保持不再變化或漏斗中的液面不再下降(2分)
(2) a, 氯化氫或HCl; 否 (3分)
(3) NH3; CO2; ①; (3分)
(4) 過濾 2NaHCO3 =Na2CO3+H2O+CO2↑ (2分)
20 . (11分)
Ⅰ. (1)酚酞(1分) 1~2滴(1分);
(2)①用干凈的玻璃棒蘸取待測液滴到pH試紙上,半分鐘后,將試紙的顏色與標準比色卡對照,讀出溶液的pH即可。(2分) ② C(1分)
(3)乙同學。(1分)
甲同學的實驗不能充分說明鹽酸的氫氧化鈉發生了反應,有可能是鹽酸和紅色物質反應生成了無色物質。乙同學的實驗,隨著滴加鹽酸,溶液的pH由大于7逐漸減少到7,這充分證明溶液中的氫氧化鈉因反應而消耗了;(2分)
Ⅱ. (4)29.2%;(2分) (5)鹽酸具有揮發性。(1分)
21. (12分)
(1)銅鋅及濃鹽酸一起組成了原電池,加快了反應速率 (2分)
(2)① 否(1分); 因為H2本身難溶于水 (1分);
②
驗證方法
預測現象及結論
將銅片加入稀硫酸中,并微熱(1分)
若無氣體放出,則不含鋅等活潑金屬雜質;
若有氣體則有鋅等雜質(1分)
(3)(任選一種方法即可)
驗證方法
預測現象及結論
向白色沉淀中加入稀HNO3等強氧化劑(1分)
溶液變藍色,說明是一價銅(1分)
向氯化亞銅懸濁液中加入氯化鉀溶液(1分)
如白色沉淀消失且得無色溶液,則原溶液為氯化亞銅,否則不是(1分)
(4).files/image064.gif) (2分);
(2分);
加水稀釋后,.files/image066.gif) <K,平衡向生成CuCl(s)的方向移動 (2分)
<K,平衡向生成CuCl(s)的方向移動 (2分)
四、(本題包括3小題,共34分)
22. (10分) (1).files/image068.gif)
(2)II因為濾液A是偏鋁酸鈉和氫氧化鈉溶液,按途徑I直接向A中加入鹽酸得到的AlCl3溶液中含有大量的氯化鈉雜質;按途徑II通入二氧化碳氣體,得Al(OH)3沉淀,將Al(OH)3溶解于鹽酸中得到的是純凈的AlCl3溶液。所以途徑II合理。
(3)蒸發濃縮、冷卻結晶
(4).files/image070.gif)
或.files/image072.gif)
(5)不合理 因為該方案操作步驟多、時間長,消耗試劑量大
(除(4)、(5)中第一個空每空1分以外,其余每空2分)
23、(共11分)
(1)BaSO4(s)+
(2)S2- + H2O .files/image073.jpg) HS- + OH-(2分)
HS- + OH-(2分)
(3)計算過程 :設每次用
BaSO4+CO32-=BaCO3+SO42-
(2.0-x) mol•L-1 x mol•L-1
.files/image075.gif) == 0.042 (2分)
== 0.042 (2分)
X = 0.081(0.084也給分) (1分);
處理次數 = 0.2mol/0.081mol=2.5(1分)(2.38也給分)。
答:至少處理3次 (1分)
(4)節能,環保 (各1分,共2分。合理答案就可得分)
24.(共13分)
(1)0.15(2分) 2(1-1/a) (3分) (2)N2+6e-+6H+=2NH3 (2分)
(3)N2 (1分) 生成NO的反應為放熱反應,升高溫度轉化率下降 (2分)
進一步與NO反應生成硝酸(1分)
(4) NO+NO2+H2O=2HNO2;(1分) CO (NH2)2+2HNO2=CO2+2N2+3H2O(1分)
五、(本題包括1小題,9分)
25.(9分)
(1)羧基、羥基(2分)
(2).files/image077.jpg) (2分)
(2分)
(3)消去反應;NaOH(或Na2CO3等其它合理答案)(2分)
(4)1、4
(5) .files/image079.jpg)
.files/image081.jpg)
.files/image083.jpg)
.files/image085.jpg) (1分)
(1分)
六、選擇題(本題包括2小題,每小題10分)
26. (10分)
(1)醛比酮容易發生該反應;
苯基酮極難發生該反應;
羰基所連的碳上氫原子越少或取代基越多或取代基的碳原子數越多,越難反應;
取代基為兩個乙基時,難以發生該反應。 (各1分,任寫三條)
(2) HCl、NaOH(或Na2CO3、Cl2能降低NaHSO3濃度的試劑 )(2分)
(3)①(CH3)2CHCOCH3 + 3Cl2 + 3NaOH → (CH3)2CHCOCCl3 + 3NaCl + 3H2O(2分)
②(CH3)2CHCOONa(1分)
(4) 氧化還原反應 (氧化反應、還原反應、歧化反應 )(1分)
萃取(或蒸餾)(1分)
27. (1)MgO>CaO>NaCl>KCl (2分)
(2) ①1s22s22p63s23p63d104s1或[Ar] 3d104s1 (1分) C(1分)
② 水的熔、沸點較高,結冰時密度減小(2分)
③正四面體(2分)
(3)B
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com