
題目列表(包括答案和解析)
下列有關溶液性質的敘述,正確的是
A、室溫時飽和的二氧化碳水溶液,冷卻到00C時,會放出CO2氣體。
B、200C,100g水可溶解34.2gKCl,此時KCl的飽和溶液的質量分數為34.2%
C、強電解質在水中溶解度一定大于弱電解質
D、相同溫度下,把水面上的空氣換成相同壓強的純氧,100g水中溶入氧氣的質量增加
X、Y、Z、W均為含有10電子的微粒,W為金屬陽離子,X、Y、Z常溫下為氣體,
(1)已知: W + X + H2O → 白色沉淀。
①若實驗室用下圖所示裝置、干燥和收集裝置制取并收集干燥的X,A中分液漏斗中的液態試劑的儀器的名稱是________,儀器的連接順序為a→________________________;
②由W離子形成的可溶性鹽WCln,其水溶液顯_________性,原因是(用離子方程式表示)_____________________________________________________
③為進一步確定W,進行如下實驗,請補全實驗操作、現象和結論:取上述白色沉淀少量置于試管中,_____________________________________________________
(2)常溫下,取10 mLpH= a的Y的稀溶液,加水稀釋時pH隨溶液體積V的變化如圖所示,則①Y的化學式為__________。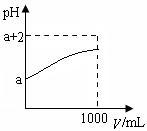
②下列有關Y的敘述正確的是__________
| A.Y溶于水后部分發生電離 |
| B.Y的水溶液中滴加石蕊試液會變紅 |
| C.稀釋后溶液中所有離子的濃度均減小 |
| D.稀釋后,陰離子的物質的量濃度之和不變 |

| A.Y溶于水后部分發生電離 |
| B.Y的水溶液中滴加石蕊試液會變紅 |
| C.稀釋后溶液中所有離子的濃度均減小 |
| D.稀釋后,陰離子的物質的量濃度之和不變 |
清洗和制絨是硅晶片制作的重要步驟之一,硅片化學清洗的主要目的是除去硅片表面雜質(如某些有機物,無機鹽,金屬、Si、SiO2粉塵等)。常用的化學清洗劑有高純水、有機溶劑、雙氧水、濃酸、強堿等。其中去除硅的氧化物,通常用一定濃度的HF溶液,室溫條件下將硅片浸泡1至數分鐘。制絨是在硅片表面形成金字塔形的絨面,增加硅對太陽光的吸收。單晶制絨通常用NaOH,Na2SiO3等混合溶液在75~90℃反應25~35 min,效果良好。
回答下列問題
(1)能否用玻璃試劑瓶來盛HF溶液,為什么?用化學方程式加以解釋 ;
(2)寫出晶片制絨反應的離子方程式 ,對單晶制絨1990年化學家Seidel提出了一種的電化學模型,他指出Si與NaOH溶液的反應,首先是Si與OH一反應,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反應中氧化劑為 。
(3)本校化學興趣小組同學,為驗證Seidel的理論是否正確,完成以下實驗:
|
|
實驗事實 |
|
事實一 |
水蒸汽在600℃時可使粉末狀硅緩慢氧化并放出氫氣。 |
|
事實二 |
盛放于鉑或石英器皿中的純水長時間對粉末狀還原硅無腐蝕作用。 |
|
事實三 |
普通玻璃器皿中的水僅因含有從玻璃中溶出的微量的堿便可使粉末狀硅在其中緩慢溶解。 |
|
事實四 |
在野外環境里,用較高百分比的硅鐵粉與干燥的Ca(OH)2和NaOH,點著后燜燒,可劇烈放出H2。 |
|
事實五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加熱(稍微預熱),收集到約1700mL H2,很接近理論值(1600mL)。 |
結論:從實驗上說明堿性水溶液條件下,H2O可作 劑;NaOH作 劑,降低反應 。高溫無水環境下,NaOH作 劑。
(4)在太陽能電池表面沉積深藍色減反膜——氮化硅晶膜。常用硅烷(SiH4)與氨氣(NH3)在等離子體中反應。硅烷是一種無色、有毒氣體,常溫下與空氣和水劇烈反應。下列關于硅烷、氮化硅的敘述不正確的是 。
A.在使用硅烷時要注意隔離空氣和水,SiH4能與水發生氧化還原反應生成H2;
B.硅烷與氨氣反應的化學方程式為:3SiH4+4NH3=Si3N4+12H2↑,反應中NH3作氧化劑;
C.它們具有卓越的抗氧化、絕緣性能和隔絕性能,化學穩定性很好,不與任何酸、堿反應;
D.氮化硅晶體中只存在共價鍵,Si3N4是優良的新型無機非金屬材料。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com