
題目列表(包括答案和解析)
(9分)有硫酸和鹽酸的混合溶液,取出![]() 加入足量的
加入足量的![]() 溶液,可得白色沉淀
溶液,可得白色沉淀![]() ,另取這種混合酸液
,另取這種混合酸液![]() 與
與![]()
![]() 溶液
溶液![]() 恰好全部中和。求:
恰好全部中和。求:
(1)混合溶液中硫酸和鹽酸的物質的量濃度是多少?
(2)再取![]() 這種混酸溶液,加入足量的鋅粉,產生的氣體在標準狀況下的體積?
這種混酸溶液,加入足量的鋅粉,產生的氣體在標準狀況下的體積?

| 實驗操作 | 預期現象和結論 |
| 步驟1:取少量粉末于燒杯中,加入足量3mol/LNaOH溶液,充分攪拌,過濾,洗滌. | 粉末減少,說明粉末可能含有Al2O3 |
| 步驟2:取少量步驟1的濾液于試管中,逐滴滴加3mol/L鹽酸至過量. | 有白色沉淀產生然后沉淀又溶解 有白色沉淀產生然后沉淀又溶解 ,說明粉末中含有Al2O3. |
| 步驟3:將步驟1的濾渣轉移到燒杯B中,加入足量3mol/L CuSO4,充分攪拌,過濾,洗滌. | 有紅色固體生成,說明粉末中含有 Fe Fe . |
| 步驟4: 將步驟3的濾渣轉移到燒杯C中, 加入足量3mol/L鹽酸,靜置,取上層清液, 滴加適量的雙氧水,充分振蕩后滴加KSCN 溶液. 將步驟3的濾渣轉移到燒杯C中, 加入足量3mol/L鹽酸,靜置,取上層清液, 滴加適量的雙氧水,充分振蕩后滴加KSCN 溶液. |
固體部分溶解,溶液變血紅色,說明粉 末中含有FeO 固體部分溶解,溶液變血紅色,說明粉 末中含有FeO |
硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得:Na2SO3 + S  Na2S2O3,常溫下溶液中析出晶體為Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有關物質的溶解度曲線如右圖所示。
Na2S2O3,常溫下溶液中析出晶體為Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有關物質的溶解度曲線如右圖所示。

Ⅰ.現按如下方法制備Na2S2O3·5H2O:
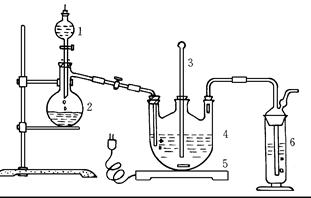
將硫化鈉和碳酸鈉按反應要求比例一并放入三頸燒瓶中,注入150mL蒸餾水使其溶解,在分液漏斗中,注入濃鹽酸,在裝置2中加入亞硫酸鈉固體,并按下圖安裝好裝置。
(1)儀器2的名稱為 ,
裝置6中可放入 。
A.BaCl2溶液 B.濃H2SO4 C.酸性KMnO4溶液 D.NaOH溶液

(2)打開分液漏斗活塞,注入濃鹽酸使反應產生的二氧化硫氣體較均勻的通入Na2S和Na2CO3的混合溶液中,并用磁力攪拌器攪動并加熱,反應原理為:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S Na2S2O3
Na2S2O3
總反應為:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
隨著二氧化硫氣體的通入,看到溶液中有大量淺黃色固體析出,繼續通二氧化硫氣體,反應約半小時。當溶液中pH接近或不小于7時,即可停止通氣和加熱。溶液PH要控制不小于7理由是
(用離子方程式表示)。
Ⅱ.分離Na2S2O3·5H2O并標定溶液的濃度:

(1)為減少產品的損失,操作①為 ,操作②是抽濾洗滌干燥,其中洗滌操作是用
(填試劑)作洗滌劑。
(2)蒸發濃縮濾液直至溶液呈微黃色渾濁為止,蒸發時為什么要控制溫度不宜過高
(3)稱取一定質量的產品配置成硫代硫酸鈉溶液,并用間接碘量法標定該溶液的濃度:用分析天平準
確稱取基準物質K2Cr2O7(摩爾質量294g/mol)0.5880克。平均分成3份分別放入3個錐形瓶中,加
水配成溶液,并加入過量的KI并酸化,發生下列反應:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入幾滴
淀粉溶液,立即用所配Na2S2O3溶液滴定,發生反應:I2+2S2O32-=2I-+S4O62-,滴定終點的現象為
三次消耗Na2S2O3溶液的平均體積為20.00mL,則所標定的硫代硫酸鈉溶液
的濃度為 mol/L。
硫代硫酸鈉(Na2S2O3)可由亞硫酸鈉和硫粉通過化合反應制得:Na2SO3 + S  Na2S2O3,常溫下溶液中析出晶體為Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有關物質的溶解度曲線如右圖所示。
Na2S2O3,常溫下溶液中析出晶體為Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有關物質的溶解度曲線如右圖所示。
Ⅰ.現按如下方法制備Na2S2O3·5H2O:
將硫化鈉和碳酸鈉按反應要求比例一并放入三頸燒瓶中,注入150mL蒸餾水使其溶解,在分液漏斗中,注入濃鹽酸,在裝置2中加入亞硫酸鈉固體,并按下圖安裝好裝置。
(1)儀器2的名稱為 ,
裝置6中可放入 。
| A.BaCl2溶液 | B.濃H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
 Na2S2O3
Na2S2O3
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com