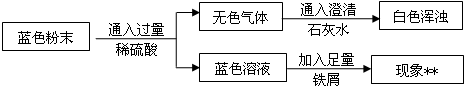
36、某活動小組的同學查閱資料得知,傳統腌制松花皮蛋的主要配料是氧化鈣、純堿和食鹽,該小組同學將這三種物質混合后加入適量的水攪拌、過濾得濾渣和濾液.
(1)寫出三種物質混合后加入水攪拌所發生的兩個反應的化學方程式.
化合反應:
CaO+H2O=Ca(OH)2
、復分解反應:
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
.
(2)對濾液中溶質的成分進行探究:
【猜想與假設】
甲同學認為:可能是NaCl、Na
2CO
3、Ca(OH)
2乙同學認為:可能是NaCl、NaOH、Na
2CO
3丙同學認為:可能是NaCl、NaOH、Ca(OH)
2 丁同學認為:可能是NaCl、NaOH
交流與評價】經過討論,大家一致認為
甲
同學的猜想不合理.理由是
Na2CO3和Ca(OH)2不能共存
.
【活動與探究】
乙同學取原濾液向其中傾倒一定量的稀鹽酸觀察到有大量氣泡產生,于是得出該濾液中的溶質是NaCl、NaOH、Na
2CO
3的結論,證實了自己的猜想.
丙同學取原濾液向其中加入Na
2CO
3溶液無現象,據此否定了自己的猜想;他又重新取原濾液,向其中加入CaCl
2溶液觀察到
有白色沉淀產生
,得出了和乙同學相同的結論.
丁同學為了驗證上述結論也取原濾液向其中加入了少量稀鹽酸,卻發現無氣泡產生.
【解釋與結論】
大家經過分析找出了丁同學所用試劑與乙同學相同,卻沒有看到氣泡的原因.你認為可能的
原因是
丁同學加入的稀鹽酸的量比較少,產生的二氧化碳被氫氧化鈉反應吸收
.