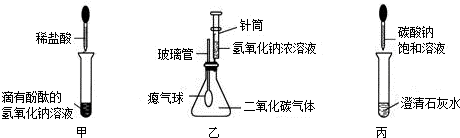
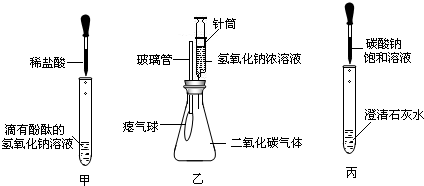
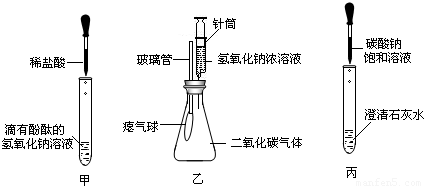
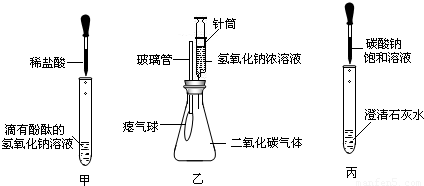
在學習堿的化學性質時,某興趣小組進行了如圖所示的實驗.
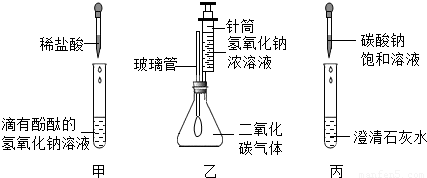
Ⅰ.實驗記錄:
①在甲實驗過程中,用溫度計測量溶液溫度,隨著稀鹽酸的不斷滴入,溶液溫度逐漸升高,你認為溶液溫度升高的原因是
,該反應的化學方程式是
;
②乙實驗中滴加氫氧化鈉溶液后,可觀察到的現象是
;
③丙實驗中觀察到試管內有白色沉淀產生;
Ⅱ.廢液成分探究:
實驗結束后,同學們將甲、乙、丙三個實驗的廢液倒入同一個干凈的廢液缸中,最終看到廢液渾濁并呈紅色,由此產生疑問.
【提出問題】廢液中含有哪些物質?
【討論交流】
①廢液中一定含有的物質:碳酸鈣、指示劑、水和
;
②還含有能使廢液呈堿性的物質.能使廢液呈堿性的物質是什么?同學們有如下猜想:
猜想1:是碳酸鈉; 猜想2:是氫氧化鈉; 猜想3:是氫氧化鈉和碳酸鈉;
你的猜想是:是
(寫一種猜想).
【實驗設計】用氯化鈣溶液來驗證上述猜想.
查閱資料獲悉氯化鈣溶液呈中性,并設計如下實驗.請將實驗設計補充完整.
| 實驗內容 | 預計現象 | 預計結論 |
| 取少量廢液缸中上層清液于試管中,加入過量氯化鈣溶液,靜置. | 沒有白色沉淀,溶液呈紅色 | 猜想2正確 |
| | 猜想1正確 |
| | 猜想3正確 |
③要驗證你的猜想,所需要的試劑和預計的現象是
.
【反思拓展】分析化學反應后所得物質成分時,除考慮生成物外還需考慮
.