
題目列表(包括答案和解析)
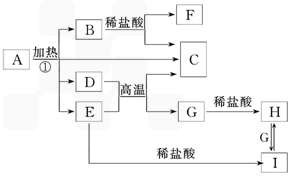
化合物A是一種重要的光化學試劑,屬不含結晶水的復鹽。A~H之間相互轉化關系如下圖所示:(部分反應物、生成物沒有列出)

已知:A中含二種陰離子和一種帶二個單位負電荷的陰離子,三種離子的個數比為3:1:3。陰離子中各元素的質量分數與C相同且式量是C的2倍。C、D都為氣體且含有元素種類相同,C能使澄清石灰水變渾濁,E是一種紅棕色的顏料,F的焰色反應呈紫色,1能使苯酚溶液顯紫色。
回答下列問題:
(1)C的電子式 。
(2)A的化學式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的離子反應方程式 .
(5)在A的溶液中滴入酸性高錳酸鉀溶液,高錳酸鉀溶液紫色褪去。而在A的溶液中滴入硫氰化鉀溶液,溶液呈紅色。產生上述現象的主要原因是 。
 ”標志的是
”標志的是清洗和制絨是硅晶片制作的重要步驟之一,硅片化學清洗的主要目的是除去硅片表面雜質(如某些有機物,無機鹽,金屬、Si、SiO2粉塵等)。常用的化學清洗劑有高純水、有機溶劑、雙氧水、濃酸、強堿等。其中去除硅的氧化物,通常用一定濃度的HF溶液,室溫條件下將硅片浸泡1至數分鐘。制絨是在硅片表面形成金字塔形的絨面,增加硅對太陽光的吸收。單晶制絨通常用NaOH、Na2SiO3等混合溶液在75~90℃反應25~35 min,效果良好。回答下列問題
Ⅰ.(1)寫出晶片制絨反應的離子方程式 ,對單晶制絨1990年化學家Seidel提出了一種的電化學模型,他指出Si與NaOH溶液的反應,首先是Si與OH一反應,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反應中氧化劑為 。
(2)本校化學興趣小組同學,為驗證Seidel的理論是否正確,完成以下實驗:
|
|
實驗事實 |
|
事實一 |
水蒸汽在600℃時可使粉末狀硅緩慢氧化并放出氫氣。 |
|
事實二 |
盛放于鉑或石英器皿中的純水長時間對粉末狀還原硅無腐蝕作用。 |
|
事實三 |
普通玻璃器皿中的水僅因含有從玻璃中溶出的微量的堿便可使粉末狀硅在其中緩慢溶解。 |
|
事實四 |
在野外環境里,用較高百分比的硅鐵粉與干燥的Ca(OH)2和NaOH,點著后燜燒,可劇烈放出H2。 |
|
事實五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加熱(稍微預熱),收集到約1700mL H2,很接近理論值(1600mL)。 |
結論:從實驗上說明堿性水溶液條件下,H2O可作 劑;NaOH作_____ 劑,降低反應 。高溫無水環境下,NaOH作 劑。
Ⅱ.在工業中利用鎂制取硅:2Mg+SiO2 2MgO+Si,同時有副反應發生:2Mg+Si
2MgO+Si,同時有副反應發生:2Mg+Si Mg2Si,Mg2Si遇鹽酸迅速反應生成SiH4(硅烷),SiH4在常溫下是一種不穩定、易分解的氣體。如圖是進行Mg與SiO2反應的實驗裝置:
Mg2Si,Mg2Si遇鹽酸迅速反應生成SiH4(硅烷),SiH4在常溫下是一種不穩定、易分解的氣體。如圖是進行Mg與SiO2反應的實驗裝置:

由于氧氣的存在對該實驗有較大影響,實驗中應通入氣體X作為保護氣,試管中的固體藥品可選用________(填序號)。 a.石灰石 b.鋅粒 c.純堿
(4)實驗開始時,必須先通入X氣體,再加熱反應物,其理由是______________________________,當反應開始后,移走酒精燈反應能繼續進行,其原因是___________________________。
(5)反應結束后,待冷卻至常溫時,往反應后的混合物中加入稀鹽酸。可觀察到閃亮的火星,產生此現象的原因用化學方程式表示為_______________________________________。
清洗和制絨是硅晶片制作的重要步驟之一,硅片化學清洗的主要目的是除去硅片表面雜質(如某些有機物,無機鹽,金屬、Si、SiO2粉塵等)。常用的化學清洗劑有高純水、有機溶劑、雙氧水、濃酸、強堿等。其中去除硅的氧化物,通常用一定濃度的HF溶液,室溫條件下將硅片浸泡1至數分鐘。制絨是在硅片表面形成金字塔形的絨面,增加硅對太陽光的吸收。單晶制絨通常用NaOH、Na2SiO3等混合溶液在75~90℃反應25~35 min,效果良好。回答下列問題
Ⅰ.(1)寫出晶片制絨反應的離子方程式 ,對單晶制絨1990年化學家Seidel提出了一種的電化學模型,他指出Si與NaOH溶液的反應,首先是Si與OH一反應,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反應中氧化劑為 。
(2)本校化學興趣小組同學,為驗證Seidel的理論是否正確,完成以下實驗:
| | 實驗事實 |
| 事實一 | 水蒸汽在600℃時可使粉末狀硅緩慢氧化并放出氫氣。 |
| 事實二 | 盛放于鉑或石英器皿中的純水長時間對粉末狀還原硅無腐蝕作用。 |
| 事實三 | 普通玻璃器皿中的水僅因含有從玻璃中溶出的微量的堿便可使粉末狀硅在其中緩慢溶解。 |
| 事實四 | 在野外環境里,用較高百分比的硅鐵粉與干燥的Ca(OH)2和NaOH,點著后燜燒,可劇烈放出H2。 |
| 事實五 | 1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加熱(稍微預熱),收集到約1700mL H2,很接近理論值(1600mL)。 |
 2MgO+Si,同時有副反應發生:2Mg+Si
2MgO+Si,同時有副反應發生:2Mg+Si Mg2Si,Mg2Si遇鹽酸迅速反應生成SiH4(硅烷),SiH4在常溫下是一種不穩定、易分解的氣體。如圖是進行Mg與SiO2反應的實驗裝置:
Mg2Si,Mg2Si遇鹽酸迅速反應生成SiH4(硅烷),SiH4在常溫下是一種不穩定、易分解的氣體。如圖是進行Mg與SiO2反應的實驗裝置:
說明:1、文字簡答題以關鍵詞到位為準,按點給分;
2、化學用語書寫:(1)方程式未配平不得分、無條件扣一半分值;
(2)化學式書寫錯誤得0分;
3、寫名稱或化學式正確的正常給分;
4、其他合理解法正常給分。
第Ⅰ卷(選擇題,共64分)
一、二:選擇題
題 號
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答 案
B
A
C
D
D
B
A
C
AD
AC
C
B
AD
B
CD
D
第Ⅱ卷(非選擇題 共86分)
三、(共2小題,22分)
17.(8分)
(1)ABDC(2分)(顛倒不得分)
(2)左(1分), 繼續往左盤小燒杯中慢慢加少量樣品,使指針指向標尺中間,直至天平平衡(1分)
(3)引流(1分) 防止液體局部過熱,液滴濺出(1分)
(4)沉淀后靜置,向上層清液中加入CaCl2溶液,觀察是否有沉淀生成,若無沉淀生成,則說明沉淀完全,反之則沉淀不完全。(1分)取最后一次洗滌液少許,滴入數滴K2CO3溶液(或AgNO3溶液等也可),若無沉淀產生,即沉淀洗滌干凈。(1分)
18(共14分)
(1)分液漏斗(1分)。Cu+4H++2NO3―=Cu2++2NO2↑+2H2O(或NO的方程式也可)(2分)。
(2)安全瓶(防止倒吸等)(1分)
(3)①坩堝(1分) ②b(1分) ③Cu+H2O2+2H+=Cu2++2H2O(2分)
④防止雙氧水分解(1分),酒精與水互溶且極易揮發,減少晶體溶解(1分),第二組(2分)
理由:第一組中的方案1需要加熱,消耗能源,方案2所得產品含有鐵元素雜質。而第二組方案幾乎不產生有害氣體,且所得產品純度較高。(2分)
四、(共2小題,18分)
19、(8分)(1)三角錐型、平面三角形、四面體(一個1分,共3分)
(2)H2O2、C2H6、CH3NH2、N2H4(H2N―NH2)(各1分,共2分,任寫2種),O22―(1分)
|