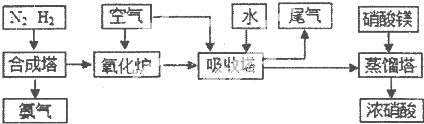
工業合成氨與制備硝酸一般可連續生產,流程如下
(1)①工業生產時,制取氫氣的一個反應為:CO+H
2O(g)?CO
2+H
2,850℃時,往1L密閉容器中充入0.3mol CO和0.2molH
2O(g).反應4min后建立平衡,體系中c(H
2)=0.12mol?L
-1.CO的平衡濃度為
0.18mol/L
0.18mol/L
轉化率為
40%
40%
該溫度下此反應的平衡常數K=
1
1
(填計算結果).
②在850℃時,以表中的物質的量投入恒容反應器中,其中向逆反應方向進行的有
A
A
(選填A、B、C、D、E)
|
A |
B |
C |
D |
E |
| n(CO2) |
3 |
l |
0 |
1 |
l |
| n(H2) |
2 |
l |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
2 |
l |
(2)合成塔中發生反應N
2(g)+3H
2(g)?2NH
3(g)△H<0.下表為不同溫度下該反應的平衡常數.由此可推知,表中T
1<
<
300℃(填“>”、“<”或“=”).
| T/°C |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)N
2和H
2在鐵作催化劑作用下從145℃就開始反應,不同溫度下NH
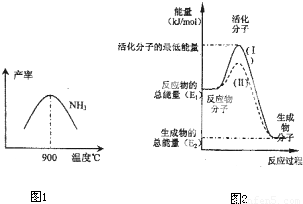
3產率圖1所示.溫度高于900℃時,NH
3產率下降,原因是
900℃時反應達到平衡狀態,再升高溫度平衡向左移動
900℃時反應達到平衡狀態,再升高溫度平衡向左移動
.
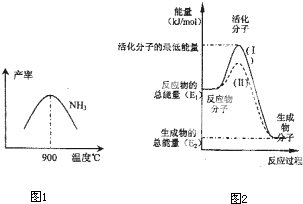
(4)在化學反應中只有極少數能量比平均能量高得多的反應物分子發生碰撞時才可能發生化學反應,這些分子被稱為活化分子.使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用kJ?mol
-1表示.請認真觀察圖2,回答問題.
圖中所示反應是
放熱
放熱
(填“吸熱”或“放熱”)反應,該反應的△H=
-(E1-E2)kJ/mol
-(E1-E2)kJ/mol
(用含E
1、E
2E的代數式表示).已知熱化學方程式:H
2(g)+
O
2(g)=H
2O(g)△H=-241.8kJ?mol
-1,該反應的活化能為167.2kJ?mol
-1,則其逆反應的活化能為
409kJ/mol
409kJ/mol
.
(5)硝酸廠的尾氣直接排放將污染空氣.目前科學家探索利用燃料氣體中的甲烷等將氮的氧化物還原為氮氣和水,反應機理為:
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H=-1160kJ?mol
-1則甲烷直接將NO
2還原為N
2的熱化學方程式為:
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
.




 O2(g)=H2O(g)△H=-241.8kJ?mol-1,該反應的活化能為167.2kJ?mol-1,則其逆反應的活化能為 .
O2(g)=H2O(g)△H=-241.8kJ?mol-1,該反應的活化能為167.2kJ?mol-1,則其逆反應的活化能為 . 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol