
題目列表(包括答案和解析)
下列反應適用于實驗室制備氧氣的是
①高錳酸鉀熱分解
2KMnO4 K2MnO4+MnO2+
O2↑
K2MnO4+MnO2+
O2↑
②硝酸銨熱分解
2NH4NO3 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑
③過氧化氫催化分解 2H2O2 2H2O +O2↑
2H2O +O2↑
④二氧化氮熱分解
2NO2  2NO+
O2↑
2NO+
O2↑
A.只有① B.①和② C.①和③ D.①③④
亞硝酸鈉是一種工業鹽,在生產、生活中應用廣泛。現用下圖所示儀器(夾持裝置已省略)及藥品,探究亞硝酸鈉與硫酸反應及生成氣體產物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②氣體液化的溫度:NO2 21℃、NO -152℃
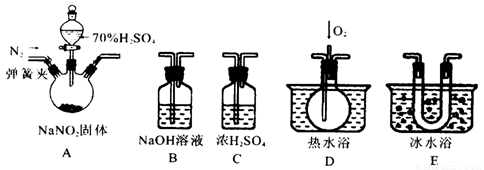
(1)為了檢驗裝置A中生成的氣體產物,儀器的連接順序為(從左向右連接):A→C→_______→_______→_______;組裝好儀器后,接下來進行的操作是________________。
(2)關閉彈簧夾,打開分液漏斗活塞,滴入70%的硫酸后, A中產生紅棕色氣體.
①確認A中產生氣體含有NO,依據的現象是_____________________________.
②裝置E的作用是_______________________________________________________
(3)如果向D中通入過量O2,則裝置B中發生反應的化學方程式為________________.
如果沒有裝置C,對實驗結論造成的影響是______________________________。
(4)通過上述實驗探究過程,可得出裝置A中反應的化學方程式是_______________。
(5)工業生產中氮氧化物的排放會造成環境污染,可采用如下方法處理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
則CH4將NO2還原為NO的熱化學方程式為:___________________________.
(14分)I.科學家一直致力于“人工固氮”的新方法研究。
(1)根據最新“人工固氮”的研究報道,在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生下列反應:2N2 (g)+6H2O (l)4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
進一步研究NH3生成量與溫度的關系,常壓下達到平衡時測得部分實驗數據如下表:
| 溫度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
① 此合成反應的a 0 (填“>”“<”或“=”)
② 已知:
N2 (g) + 3H2(g)2NH3 (g) ΔH=-92.4 kJ·mol-1,
2H2 (g)+ O2 (g)===2H2O (l) ΔH=-571.6 kJ·mol-1,
則2N2 (g) + 6H2O (l)4NH3 (g) + 3O2 (g) ΔH= ;
(2)用水稀釋0.1 mol·L-1氨水,溶液中隨著水量的增加而減小的是 (填字母標號)
II.工業生產中產生含SO2的廢氣,經石灰吸收和氧化后制成硫酸鈣,硫酸鈣是一種用途非常廣泛的產品,可用于生產硫酸、水泥等。
(1)硫酸生產中,SO2催化氧化成SO3的熱化學方程式為:
2SO2 (g) + O2(g)2SO3 (g) ΔH=-196.0 kJ·mol-1
① 容器體積不變時,為了提高SO2的轉化率,可采用的措施是 (填字母標號)
A.加入V2O5作催化劑 B.使用過量SO2 C.高溫 D.通入過量空氣
② 某溫度時,在一個容積為10L的密閉容器中充入4.0 molSO2和2.0 molO2,半分鐘后達到平衡,并放出352.8kJ的熱量。此時SO2的轉化率是 ,該溫度下的平衡常數K= ;
(2)已知25℃時,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固體的溶液中加入2.22 gCaCl2 粉末充分攪拌,假設溶液的體積變化忽略不計,則溶液中CaSO4固體的質量將 (填“增大”、“減小”或“不變”,下同),Ksp(CaSO4)將 。
近年我國汽車擁有量呈較快增長趨勢,汽車尾氣已成為重要的空氣污染物。
|
 2NO(g),是導致汽車尾氣中含有NO的原因之一。T ℃時,向容積為2 L的密閉容器中充入10 mol N2與5 mol O2,達到平衡后NO的物質的量為2 mol,則T ℃時該反應的平衡常數K= ▲ 。(計算結果保留小數點后兩位數字)
2NO(g),是導致汽車尾氣中含有NO的原因之一。T ℃時,向容積為2 L的密閉容器中充入10 mol N2與5 mol O2,達到平衡后NO的物質的量為2 mol,則T ℃時該反應的平衡常數K= ▲ 。(計算結果保留小數點后兩位數字) 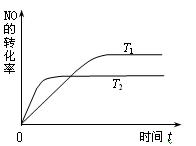
 N2(g)+O2(g)為(填“吸熱”或“放熱”) ▲ 反應。
N2(g)+O2(g)為(填“吸熱”或“放熱”) ▲ 反應。 N2(g)+O2(g) 已達到平衡的是(填序號)▲ 。
N2(g)+O2(g) 已達到平衡的是(填序號)▲ 。工業合成氨與制備硝酸一般可連續生產,流程如下:
(1)工業生產時,制取氫氣的一個反應為:CO+H2O(g) CO2+H2
CO2+H2
①t℃時,往1L密閉容器中充入0.2mol CO和0.3mol水蒸氣。反應建立平衡后,體系中c(H2)=0.12mol·L-1。該溫度下此反應的平衡常數K=_____(填計算結果)。
②保持溫度不變,向上述平衡體系中再加入0.1molCO,當反應重新建立平衡時,水蒸氣的轉化率α(H2O)=________。
(2)合成塔中發生反應N2(g)+3H2(g) 2NH3(g);△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中
2NH3(g);△H<0。下表為不同溫度下該反應的平衡常數。由此可推知,表中
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
 (3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:
(3)NH3和O2在鉑系催化劑作用下從145℃就開始反應: 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com