(2012?順義區(qū)二模)硫酸鋁銨常用于水的凈化以及工業(yè)水的處理.硫酸鋁銨是白色透明結晶硬塊,易溶于熱水,水溶液呈酸性;隨溫度升高、脫去結晶水,產生晶變.工業(yè)用鋁土礦(主要成分Al
2O
3、少量SiO
2、Fe
2O
3、MgO等)為原料制取硫酸鋁銨的工藝流程示意圖如下:
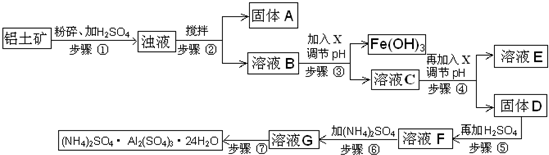
部分氫氧化物沉淀的pH如下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
| 開始沉淀pH |
3.8 |
2.7 |
9.4 |
| 完全沉淀pH |
5.2 |
3.2 |
12.4 |
請回答下列問題:
(1)步驟③中調節(jié)pH使Fe(OH)
3沉淀完全,檢驗Fe
3+是否沉淀完全的操作是
取少量溶液C于試管中,加入2~3滴KSCN溶液,若溶液變成紅色,說明Fe3+未沉淀完全;若溶液不變色,說明Fe3+已沉淀完全
取少量溶液C于試管中,加入2~3滴KSCN溶液,若溶液變成紅色,說明Fe3+未沉淀完全;若溶液不變色,說明Fe3+已沉淀完全
.
(2)若X為NaOH,步驟④中發(fā)生反應的離子方程式是
Al3+﹢3OH-=Al(OH)3↓
Al3+﹢3OH-=Al(OH)3↓
.
(3)用化學平衡移動原理解釋步驟⑤中加入硫酸的作用
硫酸電離出氫離子與氫氧化鋁電離出氫氧根離子反應生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
硫酸電離出氫離子與氫氧化鋁電離出氫氧根離子反應生成水,使Al(OH)3溶解平衡右移,至Al(OH)3溶解
.
(4)硫酸鋁銨水溶液呈酸性的原因是
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
Al3+﹢3H2O?Al (OH)3﹢3H+、NH4++H2O?NH3?H2O+H+
(用離子方程式表示).濃度均為0.1mol/L硫酸鋁和硫酸鋁銨兩種水溶液,c(Al
3+) 較大的是
硫酸鋁銨
硫酸鋁銨
(填“硫酸鋁銨”或“硫酸鋁”)溶液.
(5)步驟⑥中,要求溫度控制在90-100℃之間至硫酸銨全部溶解,其原因是
因為硫酸鋁銨易溶于熱水,有利于生成;隨溫度升高、脫去結晶水,產生晶變.所以
溫度控制在90-100℃之間
因為硫酸鋁銨易溶于熱水,有利于生成;隨溫度升高、脫去結晶水,產生晶變.所以
溫度控制在90-100℃之間
.
(6)步驟⑦的操作方法包括
冷卻,結晶、過濾、洗滌、干燥
冷卻,結晶、過濾、洗滌、干燥
.




 (2009?廣東)超細氧化鋁是一種重要的功能陶瓷原料.
(2009?廣東)超細氧化鋁是一種重要的功能陶瓷原料. Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑ Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑