
題目列表(包括答案和解析)
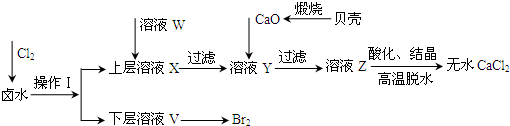
| 開始沉淀時的pH | 沉淀完全時的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
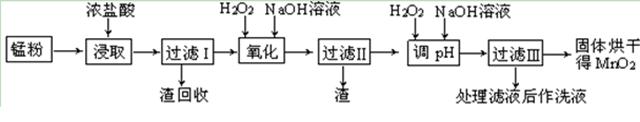
回收的廢舊鋅錳干電池經過處理后得到錳粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由錳粉制取MnO2的步驟如下圖所示。
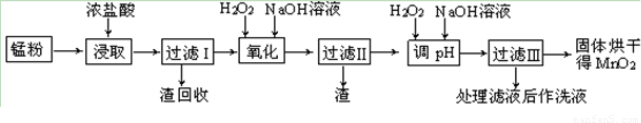
根據上圖所示步驟并參考表格數據,回答下列問題。
物 質 | 開始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
(1)在加熱條件下用濃鹽酸浸取錳粉,所得溶液中含有Mn2+、Fe2+等。MnO2與濃鹽酸反應的離子方程方程式:?????????????????????????????????????????????????????? _。
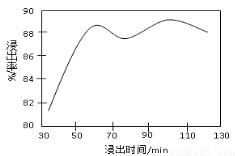
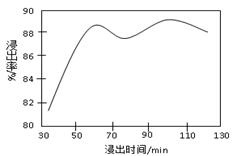
(2)酸浸時,浸出時間對錳浸出率的影響如下圖所示,工業采用的是浸取60 min,其可能原因是???????????????????????????????????????????????????? 。
(3)錳粉經濃鹽酸浸取,過濾I除去不溶雜質后,向濾液中加入足量H2O2溶液,其作用是????????????????????????????????? 。
(4)過濾I所得濾液經氧化后,需加入NaOH溶液調節pH約為5.1,其目的是?????????????????????????????????????????????? 。
(5)過濾Ⅱ所得濾液加入足量H2O2溶液并加入NaOH溶液調節pH約為9,使Mn2+ 氧化得到MnO2,反應的離于方程式為????????????????????????????????????????????????????? 。
(6)工業上利用KOH和MnO2為原料制取KMnO4。主要生產過程分兩步進行:第一步將MnO2和固體KOH粉碎,混合均勻,在空氣中加熱至熔化,并連續攪拌以制取K2MnO4;第二步為電解K2MnO4的濃溶液制取KMnO4。
① 第一步反應的化學方程式為???????????????????????????????????????????????????????????? 。
② 電解K2MnO4的濃溶液時,電解池中陰極的實驗現象為???????????????????????????????????????? 。
回收的廢舊鋅錳干電池經過處理后得到錳粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由錳粉制取MnO2的步驟如下圖所示。
根據上圖所示步驟并參考表格數據,回答下列問題。
| 物 質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |

| 物 質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |

| 物 質 | 開始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com