
題目列表(包括答案和解析)
化學反應原理在科研和生產中有廣泛應用。
(1)利用“化學蒸氣轉移法”提純金屬鎢的反應原理為W(s)+I2(g) WI2(g) (I)。該反應在石英真空管中進行,如下圖所示:
WI2(g) (I)。該反應在石英真空管中進行,如下圖所示:
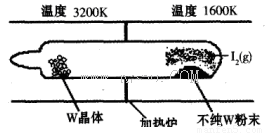
①反應(I)的平衡常數表達式K=_______,若K= ,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。
,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。
②反應(I)的△H____0(填“>”或“<”),上述反應體系中可循環使用的物質是_________。
③能夠說明上述反應已經達到平衡狀態的有_________(填序號)。
a.I2與WI2的濃度相等
b.W的質量不再變化
c.容器內混合氣體的密度保持不變
d.單位時間內,金屬鎢消耗的物質的量與碘化鎢生成的物質的量相等
(2)25℃時,NaHSO3的水解平衡常數=1.0×10-12mol/L,則該溫度下H2SO3 HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中
HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中 將________(填“增大”、“減小”或“不變”)。
將________(填“增大”、“減小”或“不變”)。
(3)直接排放含SO2的煙氣會形成酸雨,危害環境。用Na2SO3溶液吸收SO2的過程中,pH隨n(SO32-):n(HSO3-)變化關系如下表:
n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
pH(25℃) | 8.2 | 7.2 | 6.2 |
當吸收液呈中性時,溶液中離子濃度由大到小的順序為_________________________。
化學反應原理在科研和生產中有廣泛應用。
(1)利用“化學蒸氣轉移法”提純金屬鎢的反應原理為W(s)+I2(g) WI2(g) (I)。該反應在石英真空管中進行,如下圖所示:
WI2(g) (I)。該反應在石英真空管中進行,如下圖所示: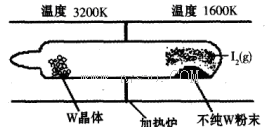
①反應(I)的平衡常數表達式K=_______,若K=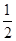 ,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。
,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。
②反應(I)的△H____0(填“>”或“<”),上述反應體系中可循環使用的物質是_________。
③能夠說明上述反應已經達到平衡狀態的有_________(填序號)。
a.I2與WI2的濃度相等
b.W的質量不再變化
c.容器內混合氣體的密度保持不變
d.單位時間內,金屬鎢消耗的物質的量與碘化鎢生成的物質的量相等
(2)25℃時,NaHSO3的水解平衡常數=1.0×10-12mol/L,則該溫度下H2SO3 HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中
HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中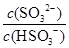 將________(填“增大”、“減小”或“不變”)。
將________(填“增大”、“減小”或“不變”)。
(3)直接排放含SO2的煙氣會形成酸雨,危害環境。用Na2SO3溶液吸收SO2的過程中,pH隨n(SO32-):n(HSO3-)變化關系如下表:
| n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
 WI2(g) (I)。該反應在石英真空管中進行,如下圖所示:
WI2(g) (I)。該反應在石英真空管中進行,如下圖所示: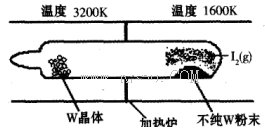
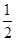 ,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。
,向某恒容密閉容器中加入1mol I2(g)和足量W(s),反應達到平衡時I2(g)的轉化率為__________。 HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中
HSO3-+H+的電離常數Ka=____mol/L,若向H2SO3溶液中加入少量的I2,則溶液中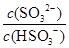 將________(填“增大”、“減小”或“不變”)。
將________(填“增大”、“減小”或“不變”)。| n(SO32-): n ( HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
(10分)有機反應具有復雜性以及產物的多樣性,因此在有機合成時,有時候需要考慮對某種官能團進行保護,有時候需要考慮取代基的位置。
Ⅰ.芳香烴取代反應中,環上的取代基對取代位置產生的影響即定位效應:
(1)甲苯的氯化及硝化的產物比例情況如下:
| 鄰位取代產物 | 間位取代產物 | 對位取代產物 |
在乙酸中,25℃下甲苯氯化反應 | 59.79% | 0.48% | 39.74% |
在硝酸硫酸中甲苯硝化反應 | 63% | 3% | 34% |
分析表中的數據,可得出的結論是
(2)下表是不同的烷基苯的硝化反應中其鄰、對位產物的情況:
產物 | C6H5-CH3 | C6H5-CH2CH3 | C6H5-CH(CH3)2 | C6H5-C(CH3)3 |
鄰位產物 | 58.45% | 45.0% | 30.0% | 15.8% |
對位產物 | 37.15% | 48.5% | 62.3% | 72.7% |
試分析在AlCl3催化條件下C6H5-CH3與Cl-C(CH3)3反應的主要產物的結構式為 ,
理由是
Ⅱ.醇氧化成醛的反應是藥物、香料合成中的重要反應之一。并且醛與飽和NaHSO3溶液可以發生以下反應,利用該反應可以分離醛和酮的混合物。
![]()
(1)在藥物、香料合成中常利用醛和醇反應生成縮醛來保護醛基,此類反應在酸催化下進行。例如: 
① 在以上醛基保護反應中要保證反應的順利進行,可采取的措施有 (寫出2條)。
。
②已知具有五元環和六元環結構的縮醛比較穩定。寫出用乙二醇(HOCH2CH2OH)保護苯
甲醛中醛基的反應方程式 。
(2)請寫出能使醛與NaHSO3反應生成的沉淀重新溶解的試劑的化學式 (寫出2種,屬于不同類別的物質。) 。
運用化學反應原理研究碳的氧化物的性質具有重要意義。
(1)CO2是一種重要的物質,但其過量排放,可能導致全球氣溫升高。下列措施不能夠有效控制CO2所導致的溫室效應的是_________(填序號)
①大力發展低碳產業,提倡低碳生活,依法控制CO2的過量排放
②禁止濫砍濫伐,植樹造林,恢復生態
③開發利用各種新型能源代替煤、石油、天然氣等化石能源
④提倡使用脫硫煤、無鉛汽油等清潔燃料
(2)常溫下,碳酸在水中的電離常數Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的電離常數Ka =4.7×10-8。寫出84消毒液露置在空氣中發生反應的離子方程式___________________________。
(3)CO具有還原性,某同學設計圖示裝置(固定裝置及膠管略去)驗證CO氣體能否與Na2O2反應。
已知: ,則實驗選擇的最簡單的裝置接口連接順序為________;
,則實驗選擇的最簡單的裝置接口連接順序為________;
若CO能夠與Na2O2發生反應,則預測反應產物為____________。實驗后用球形干燥管中的固體進行驗證可選擇的試劑是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H="-393.5" kJ·mol -1 ;CO(g)+ O2(g)=CO2(g),△H="-283.0" kJ·mol -1,寫出CO2和C(s)反應的熱化學方程式___________________。以CO為燃料制作燃料電池,電池的正極通入O2和CO2,負極通入CO,電解質是熔融碳酸鹽,放電時負極反應式為______________________。若使用該電池電解飽和食鹽水制取1molNaClO,則理論上需要氧氣的體積為(標準狀況下)________L。
O2(g)=CO2(g),△H="-283.0" kJ·mol -1,寫出CO2和C(s)反應的熱化學方程式___________________。以CO為燃料制作燃料電池,電池的正極通入O2和CO2,負極通入CO,電解質是熔融碳酸鹽,放電時負極反應式為______________________。若使用該電池電解飽和食鹽水制取1molNaClO,則理論上需要氧氣的體積為(標準狀況下)________L。
1―5CDBCC 6―10BBABA 11―15CBCDC 16―18ADB
19.(6分)(1)+1(1分) (2)CuI (1分) 0.5(2分)
(3)2、5、2、1(2分)
20.(9分)
|