
題目列表(包括答案和解析)
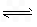 H++A-,則K=
H++A-,則K=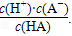 式中:K為電離平衡常數,只與溫度有關,c為各粒子的平衡濃度.下表是幾種常見弱酸的電離平衡常數(25℃).
式中:K為電離平衡常數,只與溫度有關,c為各粒子的平衡濃度.下表是幾種常見弱酸的電離平衡常數(25℃). 
對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系。若25℃時有HA![]() H++A―,則K==
H++A―,則K==![]() 式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。
式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。
| 酸 | 電離方程式 | 電離平衡常數K |
| CH3COOH | CH3COOH | 1.76×10―5 |
| H2CO3 | H2CO3 HCO3― | K1==4.31×10―7 K2==5.61×10―11 |
| H2S | H2S HS― | K1==9.1×10―8
K2==1.1×10―12 |
| H3PO4 | H3PO4 H2PO4― HPO42― |
K1==7.52×10―3 K2==6.23×10―8 K3==2.20×10―13 |
回答下列各題:
(1)K只與溫度有關,當溫度升高時,K值__________(填“增大”、“減小”、“不變”)。
(2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關系?___
__________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最強的是__________,最弱的是_____________。
(4)多元弱酸是分步電離的,每一步都有相應的電離平衡常數,對于同一種多元弱酸的K1、K2、K3之間存在著數量上的規律,此規律是________________,產生此規律的原因是_______
____________________________。
| 酸 | 點解方程式 | 電離平衡常數 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ |
K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| cα2 |
| 1-α |
| cα2 |
| 1-α |
| 酸 | 點解方程式 | 電離平衡常數 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ | K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
A、B、C、D是四種短周期元素,它們的原子序數依次增大.其中A、D元素同主族,B、C元素同周期,由A、B、C、D中的兩種元素可形成原子個數比為1∶1的多種化合物,甲、乙、丙、丁為其中的四種,它們的元素組成如下表所示:
通常狀況下,甲物質為氣體,密度略小于空氣;乙物質為液體;丙物質和丁物質為固體且都為離子化合物.請填寫下列空白:
(1)甲物質的結構式為________,丙物質的電子式為________,丁物質中陰離子與陽離子的個數比為________.
(2)若標準狀況下5.6 L甲氣體完全燃燒生成穩定氧化物時放出的熱量為325 kJ,試寫出表示甲物質燃燒熱的熱化學方程式________.
(3)研究表明乙物質具有弱酸性,則乙物質在水中的電離方程式為________.
一、選擇題(每小題3分,共51分)
題號
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
A
C
C
C
C
C
B
D
A
B
B
D
B
C
A
C
D
二、填空題(21題(1)問每空1分,其余每空2分,共19分)
18.(10分)(1)① (2)①⑤ (3)4 (4)>7 (5)D
19.(8分)(1)

(2)
(3)
 20.(9分)(1)
20.(9分)(1)

 (各1分)
(各1分)
(2)
(3) (4)
(4)

21.(14分)(1)試管上部充滿紅棕色氣體
(2)無; 與水反應生成了足量的
與水反應生成了足量的 ,中和了
,中和了
(3)
 只寫第一個給全分
只寫第一個給全分
(4) ;
; ;小
;小
22.(8分)(1)
(2)A、D
(3)3 

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com