
題目列表(包括答案和解析)
下列有某興趣小組研究濃硫酸的氧化性的結論并進行了實驗驗證:
①一般認為1:1的硫酸濃度大于60%,就具有一定的氧化性,越濃氧化性越強,60%以下的H2SO4氧化性就不怎么強了。
②溫度也影響氧化性,如銅放于冷的濃硫酸中反應不明顯,如果加熱就可以觀察到明顯現象。
③98%的濃硫酸物質的量濃度為18.4mol?L-1,密度為1.84g?cm-3
據以上信息回答:
(1)如圖裝置,同學甲先向帶支管的試管中放入銅粉和3mL水,然后從分液漏斗中加98%的濃硫酸10―15滴(約0.5mL),加熱至沸騰,該試管中液體是否有明顯變化 。(填“是”或“否”)
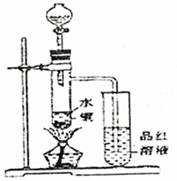
(2)甲同學再用分液漏斗加濃硫酸10mL后加熱至沸騰,現象是 。
(3)乙同學利用所示裝置直接從分液漏斗中加濃硫酸10mL與銅片反應。所觀察到與甲不同的現象是 。為了最終看到與甲類似的現象,乙同學需進行的操作是: 。
(4)乙同學進行加熱,還在帶支管的試管中觀察到有黑色物質出現,大膽假設此物質是
。
下列是某興趣小組研究濃硫酸的氧化性的結論并進行了實驗驗證:
①一般認為1:1的硫酸濃度大于60%,就具有一定的氧化性,越濃氧化性越強,60%以下的H2SO4氧化性就不怎么強了。
②溫度也影響氧化性,如銅放于冷的濃硫酸中反應不明顯,如果加熱就可以觀察到明顯現象。
③98%的濃硫酸物質的量濃度為18.4mol?L-1,密度為1.84g?cm-3據以上信息回答:
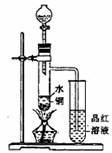
(1)如圖裝置,同學甲先向帶支管的試管中放入銅粉和3mL水,然后從分液漏斗中加98%的濃硫酸10―15滴(約0.5mL),加熱至沸騰,該試管中液體是否有明顯變化 _____。試用數據解釋原因_________________________________。
(2)甲同學再用分液漏斗加濃硫酸10mL再加熱至沸騰,現象是_____________________
__________________________。
(3)乙同學利用所示裝置直接從分液漏斗中加濃硫酸10mL與銅片反應。所觀察到與甲不同的現象是______ ___________________原因是___________ _________________。為了最終看到與甲類似的現象,乙同學需進行的操作是_______________________________________。
(4)乙同學進行加熱,還在帶支管的試管中觀察到有黑色物質出現,大膽假設此物質是_______________。
二、選擇題(48分)
13.C 14.ACD 15.AC 16.B 17.A 18.D
三、實驗題(17分)
19、實驗題
 ?)(8分)
?)(8分)
 (5分)
(5分)
連線如圖(連線正確給3分,有任何錯誤不給這3分)
?)(9分)
(1) ② (2分) ③
(2分) ③ (2分) ④斜面傾角(或填h的數值)(2分)
(2分) ④斜面傾角(或填h的數值)(2分)
(2) 不能(3分)
20.
(1)由前三列數據可知物體在斜面上勻加速下滑時的加速度為a1==5m/s2,mg sin a=ma1,可得:a=30°,
(2)由后二列數據可知物體在水平面上勻減速滑行時的加速度大小為a2==2m/s2,mmg=ma2,可得:m=0.2,
(3)由2+5t=1.1+2(0.8-t),解得t=0.1s,即物體在斜面上下滑的時間為0.5s。
21.(18分)(1)設ab上產生的感應電動勢為E,回路中電流為I,ab運動距離s所用的時間為t,則有:E=BLv I= t= Q=I2(4R)t 由上述方程得:v=
(2)設電容器兩極板間的電勢差為U,則有:U=IR
電容器所帶電荷量q=CU 解得q=
22.(1)洛侖茲力不做功,由動能定理得,mgy= mv2
mv2 ……①
……①
得 v=
 ……②
……②
(2)設在最大距離ym處的速率為vm,根據圓周運動有,qvmB-mg=m ……③
……③
且由②知 
 ……④
……④
 由③④及R=2ym得
由③④及R=2ym得  ……⑤
……⑤
(3)小球運動如圖所示,當它運動到最高點時速度最大,設為vm,此時小球在最高點的曲率半徑也為該點到x軸距離的2倍,
由動能定理
(qE-mg)|ym|= ……⑥
……⑥
由圓周運動 qvmB+mg-qE=m ……⑦
……⑦
qE =2mg ……⑧
且由⑥⑦⑧及R=2|ym|解得vm=
28. D ③ 29. A ①
化學參考答案
一、選擇題:(本題包括7小題,每題只有一個選項符合題意,每題6分,共42分)
6
7
8
9
10
11
12
C
B
A
D
C
B
C
二、(本題包括3小題,共35分)
23、(1)H2O2=HO2―+H+
(2)O2+2H2O+4e―→4OH―
(3)0.5mol
(4)2A1+2OH―+6H2O=2[A1(OH)4]―+3H2↑
(5)10―10mol?L―1c(NO3―)>c(NH4+)>c(H+)>c(OH―)
24(共16分,每空2分)
(1)否 硫酸溶質質量分數為23%<60%,其氧化性不突出所以無明顯現象
(2)銅片慢慢溶解,帶支管的試管中溶液漸成藍色小試管中品紅褪色。
化學方程式為:Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)現象是: ①液體呈淺藍色,原因是溶液中含有Cu2+;②有白色固體在試管底部析出,
原因是:98%濃H2SO4有吸水性只剩無水CuSO4。
操作是:帶支管的試管中的溶液冷卻后沿燒杯壁緩緩加入到水中,并不斷用玻璃棒拌。
25.(1)① ,減小 ② 200℃,100
MPa 200℃時反應速率過低,壓強過大對設備要求過高 ③B
(2)2NH3+60H--6e-=N2+6H2O 堿性 NH3在酸性介質中易轉化為NH4+離子
,減小 ② 200℃,100
MPa 200℃時反應速率過低,壓強過大對設備要求過高 ③B
(2)2NH3+60H--6e-=N2+6H2O 堿性 NH3在酸性介質中易轉化為NH4+離子
【物質結構】
⑴第三周期 ⅦA 1s22s22p63s23p4 ⑵2Na+2H2O=2NaOH+H2↑ 大于
⑶大 SiO2是原子晶體或 小 CO2是分子晶體 (合理即給分)
⑷Cl高氯酸的酸性大于硫酸的酸性或氯化氫穩定比硫化氫強(合理即給分)
【有機化學】
(1)C4H6O5 羥基,羥基
|