
題目列表(包括答案和解析)
某化學興趣小組的同學用以下裝置研究電化學的問題。
(1)甲裝置是由銅、鋅和稀硫酸組成的原電池,其中正極材料
 是 ,電池的總反應式用離子方程式表示
是 ,電池的總反應式用離子方程式表示
為 。當導線中有1 mol電子
通過時,理論上兩極的變化是 (填序號)。
A.鋅片溶解了32.5 g B.鋅片增重32.5 g
C.銅片上析出l g H2 D.銅片上析1molH2
(2)若乙裝置中X、Y都是惰性電極,a是滴有酚酞試液的飽和
 NaCl溶液。電解過程中觀察到 (填X或Y)
NaCl溶液。電解過程中觀察到 (填X或Y)
極附近溶液變紅色,電解反應的總化學方程式
為 。
(3)若要通過乙裝置用電解方法精煉粗銅,電解質溶液a選用
CuSO4溶液,則X電極的材料是 ,X極的
電極反應式為 。
(4)若乙裝置中X、Y都是惰性電極,a是1mol·L-1CuCl2溶液,
實驗開始10min后,CuCl2溶液濃度為0.6 mol·L-1,則反應
開始至10min,CuCl2的反應速率v(CuCl2)= 。
| A.①③⑥ | B.①③⑤ | C.②④⑤ | D.②④⑥ |
電鍍廠鍍銅廢水中含有CN-和Cr2O72-,需要處理達標后才能排放。該廠擬定下列流程進行廢水處理:
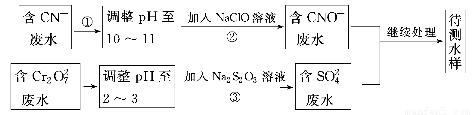
回答下列問題:
(1)上述處理廢水流程中主要使用的方法是________。
(2)②中反應后無氣體放出,該反應的離子方程式為______________________________
__________________________________。
(3)步驟③中,每處理0.4 mol Cr2O72-時轉移電子2.4 mol,該反應的離子方程式為________________________________________________________________________。
(4)取少量待測水樣于試管中,加入NaOH溶液,觀察到有藍色沉淀生成,再加Na2S溶液,藍色沉淀轉化成黑色沉淀,請使用化學用語和文字解釋產生該現象的原因:
________________________________________________________________________。
(5)目前處理酸性Cr2O72-廢水多采用鐵氧磁體法。該法是向廢水中加入FeSO4·7H2O,將Cr2O72-還原成Cr3+,調節pH,Fe、Cr轉化成相當于FeⅡ[FeCr]O4(鐵氧磁體,羅馬數字表示元素價態)的沉淀。處理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列結論正確的是________。
A.x=0.5,a=8 B.x=0.5,a=10
C.x=1.5,a=8? D.x=1.5,a=10
鐵氧磁體法處理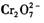 的廢水的原理可概述為:向
的廢水的原理可概述為:向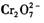 的酸性廢水中加人FeSO4·7H2O ,將
的酸性廢水中加人FeSO4·7H2O ,將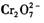 還原為Cr3+,調節溶液的 pH,使溶液中的鐵、鉻元素轉化為組成相當于FeⅡ[FeⅢ XCrⅢ 2-X]O4(鐵氧磁體、羅馬數字表示元素的價態)的沉淀。處理含 1 mol
還原為Cr3+,調節溶液的 pH,使溶液中的鐵、鉻元素轉化為組成相當于FeⅡ[FeⅢ XCrⅢ 2-X]O4(鐵氧磁體、羅馬數字表示元素的價態)的沉淀。處理含 1 mol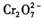 的廢水至少需要加人amol FeSO4·7H2O 。下列結論正確的是 ( )
的廢水至少需要加人amol FeSO4·7H2O 。下列結論正確的是 ( )
A.x= 0.5 , a= 8 B.x = 0.5 , a=10 C .x = 1.5 , a= 8 D.x = 1.5 , a= 10
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com