
題目列表(包括答案和解析)
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
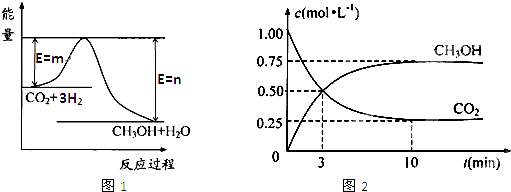
(12分)隨著人類對(duì)溫室效應(yīng)和資源短缺等問(wèn)題的重視,如何降低大氣中CO2的含量及有效地開(kāi)發(fā)利用CO2,引起了各國(guó)的普遍重視。目前工業(yè)上有一種方法是用CO2來(lái)生產(chǎn)燃料甲醇。為探究反應(yīng)原理,現(xiàn)進(jìn)行如下實(shí)驗(yàn),在體積為1 L的密閉容器中,充入lmol CO2和3mol H2,一定條件下發(fā)生反應(yīng):
CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H= —49.0kJ/mo1.
測(cè)得CO2和CH3OH(g)的濃度隨時(shí)間變化如圖所示。
(1)從反應(yīng)開(kāi)始到平衡,氫氣的平均反應(yīng)速率v(H2)= mol/(L·min)
(2)該反應(yīng)的平衡常數(shù)為 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高溫度 B.充入He(g),使體系壓強(qiáng)增大
C.將H2O(g)從體系中分離 D.再充入lmol CO2和3mol H2
(4)已知在常溫常壓下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
則甲醇的燃燒熱化學(xué)方程式為: ;
(5)如果燃燒甲醇會(huì)造成大量化學(xué)能損失,如果以甲醇和空氣為原料,以氫氧化鈉為電解質(zhì)溶液設(shè)計(jì)成原電池將有很多優(yōu)點(diǎn),請(qǐng)書(shū)寫出該電池的負(fù)極反應(yīng):___________________
(6)常溫下,某水溶液M中存在的離子有:Na+、A—、H+、OH—。若該溶液M由 pH=3的HA溶液![]() mL與pH=11的NaOH溶液
mL與pH=11的NaOH溶液![]() mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。
mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。
A.若溶液M呈中性,則溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,則溶液M的pH一定等于7
C.若溶液M呈酸性,則V1一定大于V2
D.若溶液M呈堿性,則V1一定小于V2
(12分)隨著人類對(duì)溫室效應(yīng)和資源短缺等問(wèn)題的重視,如何降低大氣中CO2的含量及有效地開(kāi)發(fā)利用CO2,引起了各國(guó)的普遍重視。目前工業(yè)上有一種方法是用CO2來(lái)生產(chǎn)燃料甲醇。為探究反應(yīng)原理,現(xiàn)進(jìn)行如下實(shí)驗(yàn),在體積為1 L的密閉容器中,充入lmol CO2和3mol H2,一定條件下發(fā)生反應(yīng):
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
測(cè)得CO2和CH3OH(g)的濃度隨時(shí)間變化如圖所示。
(1)從反應(yīng)開(kāi)始到平衡,氫氣的平均反應(yīng)速率v(H2)= mol/(L·min)
(2)該反應(yīng)的平衡常數(shù)為 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高溫度 B.充入He(g),使體系壓強(qiáng)增大
C.將H2O(g)從體系中分離 D.再充入lmol CO2和3mol H2
(4)已知在常溫常壓下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g)△H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
則甲醇的燃燒熱化學(xué)方程式為: ;
(5)如果燃燒甲醇會(huì)造成大量化學(xué)能損失,如果以甲醇和空氣為原料,以氫氧化鈉為電解質(zhì)溶液設(shè)計(jì)成原電池將有很多優(yōu)點(diǎn),請(qǐng)書(shū)寫出該電池的負(fù)極反應(yīng):___________________
(6)常溫下,某水溶液M中存在的離子有:Na+、A—、H+、OH—。若該溶液M由 pH=3的HA溶液 mL與pH=11的NaOH溶液
mL與pH=11的NaOH溶液 mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。
mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。
A.若溶液M呈中性,則溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,則溶液M的pH一定等于7
C.若溶液M呈酸性,則V1一定大于V2
D.若溶液M呈堿性,則V1一定小于V2
(12分)隨著人類對(duì)溫室效應(yīng)和資源短缺等問(wèn)題的重視,如何降低大氣中CO2的含量及有效地開(kāi)發(fā)利用CO2,引起了各國(guó)的普遍重視。目前工業(yè)上有一種方法是用CO2來(lái)生產(chǎn)燃料甲醇。為探究反應(yīng)原理,現(xiàn)進(jìn)行如下實(shí)驗(yàn),在體積為1 L的密閉容器中,充入lmol CO2和3mol H2,一定條件下發(fā)生反應(yīng):
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
測(cè)得CO2和CH3OH(g)的濃度隨時(shí)間變化如圖所示。

(1)從反應(yīng)開(kāi)始到平衡,氫氣的平均反應(yīng)速率v(H2)= mol/(L·min)
(2)該反應(yīng)的平衡常數(shù)為 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高溫度 B.充入He(g),使體系壓強(qiáng)增大
C.將H2O(g)從體系中分離 D.再充入lmol CO2和3mol H2
(4)已知在常溫常壓下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
則甲醇的燃燒熱化學(xué)方程式為: ;
(5)如果燃燒甲醇會(huì)造成大量化學(xué)能損失,如果以甲醇和空氣為原料,以氫氧化鈉為電解質(zhì)溶液設(shè)計(jì)成原電池將有很多優(yōu)點(diǎn),請(qǐng)書(shū)寫出該電池的負(fù)極反應(yīng):___________________
(6)常溫下,某水溶液M中存在的離子有:Na+、A—、H+、OH—。若該溶液M由 pH=3的HA溶液 mL與pH=11的NaOH溶液
mL與pH=11的NaOH溶液 mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。
mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。
A.若溶液M呈中性,則溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,則溶液M的pH一定等于7
C.若溶液M呈酸性,則V1一定大于V2
D.若溶液M呈堿性,則V1一定小于V2
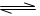 CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
 mL與pH=11的NaOH溶液
mL與pH=11的NaOH溶液 mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。
mL混合反應(yīng)而得,則下列說(shuō)法中正確的是 __。百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com