
題目列表(包括答案和解析)
工業制硫酸時,利用催化氧化反應將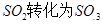 是一個關鍵的步驟。
是一個關鍵的步驟。
(1)某溫度下, 。開始時在100L的密閉容器中加入4.0molSO2(g)和10.0molO2,當反應達到平衡時共放出熱量196kJ,該溫度下平衡常數K=____________。
。開始時在100L的密閉容器中加入4.0molSO2(g)和10.0molO2,當反應達到平衡時共放出熱量196kJ,該溫度下平衡常數K=____________。
(2)一定條件下,向一帶活塞的密閉容器中充入2mol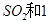 mol
mol ,發生反應:
,發生反應: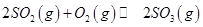 ,達平衡后改變下述條件,
,達平衡后改變下述條件,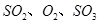 氣體平衡濃度都比原來增大的是____________(填字母)。
氣體平衡濃度都比原來增大的是____________(填字母)。
A.保持溫度和容器體積不變,充入2mol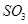
B.保持溫度和容器體積不變,充入2molN2
C.保持溫度和容器內壓強不變,充入1mol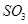
D.移動活塞壓縮氣體
E.升高溫度
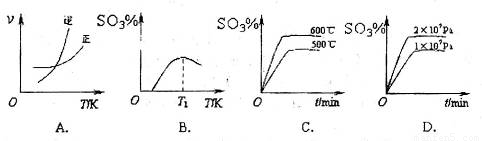
(3)下列關于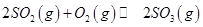 反應的圖像中,不正確的是_________。
反應的圖像中,不正確的是_________。
(4)同學們學習了電化學知識后大家提出,可以用電解的方法來生產硫酸,可避免產生酸雨,污染環境。于是大家設計了一個以鉑為電極,兩極分別通入SO2和空氣,酸性電解液來實現電解生產硫酸。
①陽極的電極反應為______________________________。
②若電解液為2L0.025mol 的硫酸溶液,當電解過程共轉移了0.1mol電子時,理論上消耗SO2的體積為(標準狀況)為_________,此溶液的pH=__________
(忽略溶液體積變化)。
的硫酸溶液,當電解過程共轉移了0.1mol電子時,理論上消耗SO2的體積為(標準狀況)為_________,此溶液的pH=__________
(忽略溶液體積變化)。
③設計此實驗的想法得到了老師的充分肯定,但與工業上生產硫酸相比還是有很多不足,請對此實驗進行合理的評價____________________________(寫出一點即可)。
 SO3(g)△H=-98 kJ/mol。開始時在100 L的密閉容器中加入4.0 mol SO2(g)和10.0 mol O2(g),當反應達到平衡時共放出196kJ的熱量,該溫度下的平衡常數K=_________。
SO3(g)△H=-98 kJ/mol。開始時在100 L的密閉容器中加入4.0 mol SO2(g)和10.0 mol O2(g),當反應達到平衡時共放出196kJ的熱量,該溫度下的平衡常數K=_________。  2SO3(g),達到平衡后,改變下述條件,SO2、O2、SO3的平衡濃度都比原來增大的是_______(填字母)。
2SO3(g),達到平衡后,改變下述條件,SO2、O2、SO3的平衡濃度都比原來增大的是_______(填字母)。 
 2SO3(g)反應的圖像中,正確的是______________。
2SO3(g)反應的圖像中,正確的是______________。 
工業制硫酸時,利用催化氧化反應將SO2轉化為SO3是一個的關鍵步驟。
(1)某溫度下,SO2(g)+![]() O2(g)
O2(g)![]() SO3(g)△H=-98 kJ·mol-1。開始時在
SO3(g)△H=-98 kJ·mol-1。開始時在
100 L的密閉容器中加入4.0 mol SO2(g)和10.0 mol O2(g),當反應達到平衡時共放出熱量196 kJ,該溫度下平衡常數K= 。
(2)一定條件下,向一帶活塞的密閉容器中充入2molSO2和1molO2,發生下列反應:
2SO2(g)+O2(g)![]() 2SO3(g),達到平衡后改變下述條件,SO2、O2、SO3氣體平衡濃度都比原來增大的是 (填字母)。
2SO3(g),達到平衡后改變下述條件,SO2、O2、SO3氣體平衡濃度都比原來增大的是 (填字母)。
A.保持溫度和容器體積不變,充入2 mol SO3
B.保持溫度和容器體積不變,充入2 mol N2
C.保持溫度和容器體積不變,充入0.5 mol SO2和0.25 mol O2
D.保持溫度和容器內壓強不變,充入1 mol SO3
E.升高溫度
 (3)某人設想以右圖所示裝置用電化學原理生產硫酸,寫出通入SO2 的電極的電極反應式: 。檢驗其中產物有SO42-的具體操作為 。
(3)某人設想以右圖所示裝置用電化學原理生產硫酸,寫出通入SO2 的電極的電極反應式: 。檢驗其中產物有SO42-的具體操作為 。
(4)常溫時,BaSO4的Ksp==1.08x10-10.現將等體積的BaCl2溶液與2.0x10-3mol/l的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小濃度為______________。
(5)下列關于2SO2(g)+O2(g)![]() 2SO3(g)反應的圖像中,正確的是 。
2SO3(g)反應的圖像中,正確的是 。

(6)SO2有氧化性又有還原性,還有漂白性。將SO2氣體通入酸性KMnO4中,酸性KMnO4褪色,其中SO2體現出的性質是 。
1―5 CADAA 6―10 ACBDA 11―15 CDBCC 16―
18.AB 19.AC 20.BD
21.(1)①B ②BDF ③偏小
(2)①酒精燈
②在干燥器中冷卻是為了防止空氣中的H2O影響結果
③
④偏高
|