
題目列表(包括答案和解析)
海水淡化可采用膜分離技術(shù)。如下圖所示,對(duì)淡化膜右側(cè)的海水加壓,水分子可以透過(guò)淡化膜進(jìn)入左側(cè)淡水池,而海水中其它各種離子不能通過(guò)淡化膜,從而得到淡水。對(duì)加壓后右側(cè)海水成分變化分析正確的是( )
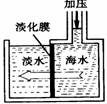
A.溶質(zhì)質(zhì)量增加 B.溶液質(zhì)量不變 C.溶劑質(zhì)量減少 D.溶質(zhì)質(zhì)量分?jǐn)?shù)減少
水處理主要包括水的凈化、污水處理、硬水軟化和海水淡化等。
(1)水處理技術(shù)的核心是減少或除去水中的各種雜質(zhì)離子。目前,_______ 和_______是主要的去離子方法。
(2)根據(jù)廢水中所含有害物質(zhì)的不同,工業(yè)上有多種廢水的處理方法。

①廢水I若采用CO2處理,離子方程式是_______。
②廢水Ⅱ常用明礬處理。實(shí)踐中發(fā)現(xiàn)廢水中的c(HCO3-)越大,凈水效果越好,這是因?yàn)?/span>________。
③廢水III中的汞元素存在如下轉(zhuǎn)化(在空格上填相應(yīng)的化學(xué)式):Hg2++_______=CH3Hg++H+。我國(guó)規(guī)定,Hg2+的排放標(biāo)準(zhǔn)不能超過(guò)0. 05 mg/L。若某工廠排放的廢水1L中含 ,是否達(dá)到了排放標(biāo)準(zhǔn)_______(填“是”或“否”)。
,是否達(dá)到了排放標(biāo)準(zhǔn)_______(填“是”或“否”)。
④廢水Ⅳ常用Cl2氧化CN-成CO2和N2。,若參加反應(yīng)的Cl2與CN-的物質(zhì)的量之比為5:2,則該反應(yīng)的離子方程式為____________
(3)地下水往往含有鈣、鎂的碳酸鹽,自來(lái)水廠需要對(duì)地下水進(jìn)行________處理。把進(jìn)行過(guò)離子交換的CaR2(或MgR2)型樹(shù)脂置于_______中浸泡一段時(shí)間后便可再生。
(4)海水的淡化是除去海水中所含的鹽分,如圖是海水中利用電滲析法獲得淡水的原理圖,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等離子,電極為惰性電極。請(qǐng)回答:

①陽(yáng)離子交換膜是指____(填“A”或“B”)。②寫(xiě)出通電后陽(yáng)極區(qū)的電極反應(yīng)式____。
水處理主要包括水的凈化、污水處理、硬水軟化和海水淡化等。
(1)水處理技術(shù)的核心是減少或除去水中的各種雜質(zhì)離子。目前,_______ 和_______是主要的去離子方法。
(2)根據(jù)廢水中所含有害物質(zhì)的不同,工業(yè)上有多種廢水的處理方法。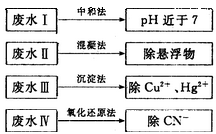
①?gòu)U水I若采用CO2處理,離子方程式是_______。
②廢水Ⅱ常用明礬處理。實(shí)踐中發(fā)現(xiàn)廢水中的c(HCO3-)越大,凈水效果越好,這是因?yàn)開(kāi)_______。
③廢水III中的汞元素存在如下轉(zhuǎn)化(在空格上填相應(yīng)的化學(xué)式):Hg2++_______=CH3Hg++H+。我國(guó)規(guī)定,Hg2+的排放標(biāo)準(zhǔn)不能超過(guò)0. 05 mg/L。若某工廠排放的廢水1L中含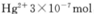 ,是否達(dá)到了排放標(biāo)準(zhǔn)_______(填“是”或“否”)。
,是否達(dá)到了排放標(biāo)準(zhǔn)_______(填“是”或“否”)。
④廢水Ⅳ常用Cl2氧化CN-成CO2和N2。,若參加反應(yīng)的Cl2與CN-的物質(zhì)的量之比為5:2,則該反應(yīng)的離子方程式為_(kāi)___________
(3)地下水往往含有鈣、鎂的碳酸鹽,自來(lái)水廠需要對(duì)地下水進(jìn)行________處理。把進(jìn)行過(guò)離子交換的CaR2(或MgR2)型樹(shù)脂置于_______中浸泡一段時(shí)間后便可再生。
(4)海水的淡化是除去海水中所含的鹽分,如圖是海水中利用電滲析法獲得淡水的原理圖,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等離子,電極為惰性電極。請(qǐng)回答: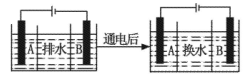
①陽(yáng)離子交換膜是指____(填“A”或“B”)。②寫(xiě)出通電后陽(yáng)極區(qū)的電極反應(yīng)式____。

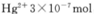 ,是否達(dá)到了排放標(biāo)準(zhǔn)_______(填“是”或“否”)。
,是否達(dá)到了排放標(biāo)準(zhǔn)_______(填“是”或“否”)。
【化學(xué)——選修2:化學(xué)與技術(shù)】(15分)
通過(guò)海水能獲得淡水、食鹽、鎂等,食鹽可進(jìn)一步用于氯堿工業(yè)。請(qǐng)回答下列問(wèn)題。
(1)列舉兩種海水淡化的方法:_________、_________。
(2)氯堿工業(yè)通過(guò)電解飽和食鹽水能獲得燒堿和氯氣等物質(zhì),該反應(yīng)的化學(xué)方程式為_(kāi)____________,如圖是用離子交換膜法電解飽和食鹽水的原理示意圖。其中石墨接電源_________極,電解時(shí)鐵電極的電極反應(yīng)式為_(kāi)________。電解過(guò)程中通過(guò)離子交換膜的主要離子是__________。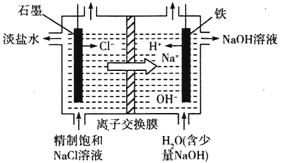
(3)侯氏制堿法中,首先向飽和食鹽水中通入CO2和NH3制備NaHCO3,其化學(xué)方程式為_(kāi)___________;先通入的是__________(填化學(xué)式),其理由是__________________ ;再利用NaHCO3受熱分解可制備純堿。
(4)目前世界上60%以上的鎂都是從海水中提取的,已知:MgO和MgCl2的熔點(diǎn)分別為2852℃和714℃。分析說(shuō)明工業(yè)上采用電解熔融MgCl2而不是電解熔融MgO的理由__________ ______________________________________________________________________ 。
一、選擇題(本題包括20小題,1―10題每題2分,11―20題每題3分,共50分。每小題只有一個(gè)選項(xiàng)符合題意)
1―5 DCBBA 6―10 CBCCB 11―15 BDCAD 16―20 DAADA
二、(本題包括3小題,共21分)
21.(6分)
(1)KOH(1分)
(2)Ar K+(Ca2+、HS-、S2-、 ) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【錯(cuò)的倒扣分,多寫(xiě)的同類重復(fù)的不倒扣分】(4分)
) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【錯(cuò)的倒扣分,多寫(xiě)的同類重復(fù)的不倒扣分】(4分)
(3) (1分)
(1分)
22.(10分)
(1)FeCl2 KSCN(或NH4SCN)溶液(2分)
(2)d(2分)
(3) (2分)
(2分)
(4)溶液中的Fe2+被氧化劑氧化成Fe3+,使Fe3+增多從而使紅色加深(1分)
(5)假設(shè):加入還原劑將Fe3+還原(1分)
用膠頭滴管取少量黃色褪色后的溶液于試管中,滴加少量KSCN溶液,再加入幾滴氯水,如果溶液開(kāi)始不出現(xiàn)紅色,加氯水后出現(xiàn)紅色,則說(shuō)明假設(shè)正確,若溶液不變紅色,則假設(shè)不正確。(2分)(有其他合理假設(shè)、答案也可酌情得分)。
23.(5分)
(1) (1分)
(1分)
(2)CH3CHO(1分)
(3)HCOOH(1分)
(4)DE(2分)
三、(本題包括2小題,共15分)
24.(10分)
(1)B、E、F、I(4分,多選、漏選、錯(cuò)選一個(gè)扣1分,扣完為止)
(2)D(1分)制氯氣的D中進(jìn)氣導(dǎo)管應(yīng)深入集氣瓶底,(1分)逸出的氯氣應(yīng)通入盛有燒堿溶液的燒杯中。(1分)
干燥氨氣;(1分)
 (2分)
(2分)
25.(5分)
(1) (1分)
(1分)
(2)甲 現(xiàn)象:氣球膨脹
原因:二氧化碳和氫氧化鈉溶液反應(yīng),使錐形瓶?jī)?nèi)氣體壓強(qiáng)減小,大氣壓使氣球脹大。(2分)
乙 現(xiàn)象:燒杯內(nèi)的水流入錐形瓶中
原因:二氧化碳和氫氧化鈉溶液反應(yīng),使錐形瓶?jī)?nèi)氣體壓強(qiáng)減小,大氣壓將水壓入錐形瓶中。(2分)
四、(本題包括2小題,共14分)
26.(8分)
(1)甲基丙烯或2―甲基丙烯  (2分,各1分)
(2分,各1分)
(2)②取代反應(yīng)(或水解反應(yīng)) ④消去反應(yīng)(2分,各1分)
(3)(2分)

(4) (2分,其他合理寫(xiě)法都給分)
(2分,其他合理寫(xiě)法都給分)
27.(6分)
(1)8.0 mol/L(2分)(注意有效數(shù)字)
(2) (或
(或 )(2分)
)(2分)
畫(huà)圖(2分)

百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com