
題目列表(包括答案和解析)
CO和H2可作為能源和化工原料,應用十分廣泛.
(1)已知:C(s)+O2(g)![]() CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH2=-483.6 kJ·mol-1
2H2O(g) ΔH2=-483.6 kJ·mol-1
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1
則反應
CO(g)+H2(g)+O2(g)標準狀況下的煤炭氣
(CO、H2)336 L與氧氣反應生成CO2和H2O,反應過程中轉(zhuǎn)移________mol電子.(2)
熔融碳酸鹽燃料電池(MCFS),是用煤氣(CO+H2)作負極燃氣,空氣與CO2的混合氣為正極助燃氣,用一定比例的Li2CO3和Na2CO3低熔點混合物做電解質(zhì),以金屬鎳(燃料極)為催化劑制成的.負極的電極反應式為:CO+H2-4e-+2CO32-(3)
密閉容器中充有1 mol CO與2 mol H2,在催化劑作用下反應生成甲醇:CO(g)+2H2(g)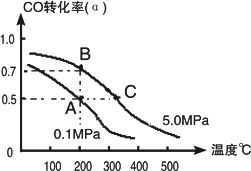
①若A、B兩點表示在某時刻達到的平衡狀態(tài),此時在A點時容器的體積為10 L,則該溫度下的平衡常數(shù)K=________;此時在B點時容器的體積VB________10 L(填“大于”、“小于”或“等于”).
②若A、C兩點都表示達到的平衡狀態(tài),則自反應開始到達平衡狀態(tài)所需的時間tC________tA(填“大于”、“小于”或“等于”).
③在不改變反應物用量情況下,為提高CO轉(zhuǎn)化率可采取的措施是________.(寫出兩點即可)
“潔凈煤技術(shù)”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續(xù)產(chǎn)出了熱值高達122500~16000 kJ·m-3的煤炭氣,其主要成分是CO和H2.CO和H2可作為能源和化工原料,應用十分廣泛.

(1)已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1;①
2H2(g)+O2(g)=2H2O(g);ΔH2=-483.6 kJ·mol-1;②
C(s)+H2O(g)=CO(g)+H2(g);ΔH3=+131.3 kJ·mol-1;③
則反應CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),ΔH=________kJ·mol-1.標準狀況下的煤炭氣(CO、H2)33.6 L與氧氣完全反應生成CO2和H2O,反應過程中轉(zhuǎn)移________mole-.
(2)工作溫度650℃的熔融鹽燃料電池,是用煤炭氣(CO、H2)作負極燃氣,空氣與CO2的混合氣體在正極反應,用一定比例的Li2CO3和Na2CO3低熔點混合物做電解質(zhì),以金屬鎳(燃料極)為催化劑制成的.負極的電極反應式為:CO+H2-4e-+2CO![]() =3CO2+H2O;則該電池的正極反應式為________.
=3CO2+H2O;則該電池的正極反應式為________.
(3)密閉容器中充有10 mol CO與20 mol H2,在催化劑作用下反應生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的平衡轉(zhuǎn)化率(α)與溫度、壓強的關(guān)系如右圖所示.
CH3OH(g);CO的平衡轉(zhuǎn)化率(α)與溫度、壓強的關(guān)系如右圖所示.
①若A、B兩點表示在某時刻達到的平衡狀態(tài),此時在A點時容器的體積為VAL,則該溫度下的平衡常數(shù)K=________;A、B兩點時容器中物質(zhì)的物質(zhì)的量之比為n(A)總:n(B)總=________.
②若A、C兩點都表示達到的平衡狀態(tài),則自反應開始到達平衡狀態(tài)所需的時間tA________tC(填“大于”、“小于”或“等于”).
③在不改變反應物用量的情況下,為提高CO的轉(zhuǎn)化率可采取的措施是________.
A降溫
B加壓
C使用催化劑
D將甲醇從混合體系中分離出來
(14分) “潔凈煤技術(shù)”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續(xù)產(chǎn)出了熱值高達122500~16000 kJ·m-3的煤炭氣,其主要成分是CO和H2。CO和H2可作為能源和化工原料,應用十分廣泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
則反應CO(g)+H2(g) +O2(g)=H2O(g)+CO2(g),ΔH= kJ·mol-1。標準狀況下的煤炭氣(CO、H2)33.6 L與氧氣完全反應生成CO2和H2O,反應過程中轉(zhuǎn)移 mol e-。
(2)工作溫度650℃的熔融鹽燃料電池,是用煤炭氣(CO、H2)作負極燃氣,空氣與CO2的混合氣體在正極反應,用一定比例的Li2CO3和Na2CO3低熔點混合物做電解質(zhì),以金屬鎳(燃料極)為催化劑制成的。負極的電極反應式為:CO+H2-4e-+2CO32-=3CO2+H2O;則該電池的正極反應式為 。
(3)密閉容器中充有10mol CO與20 mol H2,在催化劑作用下反應生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的平衡轉(zhuǎn)化率(α)與溫度、壓強的關(guān)系如右圖所示。
①若A、B兩點表示在某時刻達到的平衡狀態(tài),此時在A點時容器的體積為VAL,則該溫度下的平衡常數(shù)K= ;A、B兩點時容器中物質(zhì)的物質(zhì)的量之比為n(A)總:n(B)總= 。
②若A、C兩點都表示達到的平衡狀態(tài),則自反應開始到達平衡狀態(tài)所需的時間tA tC(填“大于”、“小于”或“等于”)。
③在不改變反應物用量的情況下,為提高CO的轉(zhuǎn)化率可采取的措施是 。
A 降溫 B 加壓 C 使用催化劑 D 將甲醇從混合體系中分離出來
(14分) “潔凈煤技術(shù)”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續(xù)產(chǎn)出了熱值高達122500~16000 kJ·m-3的煤炭氣,其主要成分是CO和H2。CO和H2可作為能源和化工原料,應用十分廣泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
則反應CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。標準狀況下的煤炭氣(CO、H2)33.6 L與氧氣完全反應生成CO2和H2O,反應過程中轉(zhuǎn)移 mol e-。
(2)工作溫度650℃的熔融鹽燃料電池,是用煤炭氣(CO、H2)作負極燃氣,空氣與CO2的混合氣體在正極反應,用一定比例的Li2CO3和Na2CO3低熔點混合物做電解質(zhì),以金屬鎳(燃料極)為催化劑制成的。負極的電極反應式為:CO+H2-4e-+2CO32-=3CO2+H2O;則該電池的正極反應式為 。
(3)密閉容器中充有10 mol CO與20 mol H2,在催化劑作用下反應生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡轉(zhuǎn)化率(α)與溫度、壓強的關(guān)系如右圖所示。
CH3OH(g);CO的平衡轉(zhuǎn)化率(α)與溫度、壓強的關(guān)系如右圖所示。
①若A、B兩點表示在某時刻達到的平衡狀態(tài),此時在A點時容器的體積為VAL,則該溫度下的平衡常數(shù)K= ;A、B兩點時容器中物質(zhì)的物質(zhì)的量之比為n(A)總:n(B)總= 。
②若A、C兩點都表示達到的平衡狀態(tài),則自反應開始到達平衡狀態(tài)所需的時間tA tC(填“大于”、“小于”或“等于”)。
③在不改變反應物用量的情況下,為提高CO的轉(zhuǎn)化率可采取的措施是 。
A 降溫 B 加壓 C 使用催化劑 D 將甲醇從混合體系中分離出來
(14分) “潔凈煤技術(shù)”研究在世界上相當普遍,科研人員通過向地下煤層氣化爐中交替鼓入空氣和水蒸氣的方法,連續(xù)產(chǎn)出了熱值高達122500~16000 kJ·m-3的煤炭氣,其主要成分是CO和H2。CO和H2可作為能源和化工原料,應用十分廣泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
則反應CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。標準狀況下的煤炭氣(CO、H2)33.6 L與氧氣完全反應生成CO2和H2O,反應過程中轉(zhuǎn)移 mol e-。
(2)工作溫度650℃的熔融鹽燃料電池,是用煤炭氣(CO、H2)作負極燃氣,空氣與CO2的混合氣體在正極反應,用一定比例的Li2CO3和Na2CO3低熔點混合物做電解質(zhì),以金屬鎳(燃料極)為催化劑制成的。負極的電極反應式為:CO+H2-4e-+2CO32-=3CO2+H2O;則該電池的正極反應式為 。
(3)密閉容器中充有10
mol CO與20 mol H2,在催化劑作用下反應生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡轉(zhuǎn)化率(α)與溫度、壓強的關(guān)系如右圖所示。
CH3OH(g);CO的平衡轉(zhuǎn)化率(α)與溫度、壓強的關(guān)系如右圖所示。
①若A、B兩點表示在某時刻達到的平衡狀態(tài),此時在A點時容器的體積為VAL,則該溫度下的平衡常數(shù)K= ;A、B兩點時容器中物質(zhì)的物質(zhì)的量之比為n(A)總:n(B)總= 。
②若A、C兩點都表示達到的平衡狀態(tài),則自反應開始到達平衡狀態(tài)所需的時間tA tC(填“大于”、“小于”或“等于”)。
③在不改變反應物用量的情況下,為提高CO的轉(zhuǎn)化率可采取的措施是 。
A 降溫 B 加壓 C 使用催化劑 D 將甲醇從混合體系中分離出來
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com