
題目列表(包括答案和解析)
 電解原理在化學工業上有著廣泛的應用,按下圖所示所示裝置進行電解實驗。A、B、C、D均為惰性電極,開始電解前在甲裝置的A、B極兩側各滴入酚酞試液。
電解原理在化學工業上有著廣泛的應用,按下圖所示所示裝置進行電解實驗。A、B、C、D均為惰性電極,開始電解前在甲裝置的A、B極兩側各滴入酚酞試液。
工作一段時間后:
(1)A極附近可觀察到的現象是_____________________
_______________________________________________;
檢驗B電極上反應產物的通常方法是_____________;
甲電池中電解反應的離子方程式是 _______________________________________;
溶液中還可能存在的離子反應方程式是 ____________________________________。
(2)甲槽溶液的pH________________________(填“增大”、“不變”或 “減小”,下同);乙槽溶液的pH_______________。當A極上收集到22.4L氣體(標準狀況)時,乙裝置的C極上可得到____________g金屬單質。
利用A、D兩極上析出的物質制成的燃料電池,是符合綠色化學理念的新型發電裝置。下圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定。請回答(3)~(6):
(3)氫氧燃料電池的能量轉化主要形式是 ,
 在導線中電子流動方向為 (用a、b 表示)。
在導線中電子流動方向為 (用a、b 表示)。
(4)負極反應式為 ____________。
(5)電極表面鍍鉑粉的原因為 __________
(6)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能。因此,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
Ⅰ.2Li+H2=2LiH Ⅱ.LiH+H2O==LiOH+H2↑
①反應Ⅰ中的還原劑是 ,反應Ⅱ中的氧化劑是 。
②先用鋰吸收224L(標準狀況)H2,將生成的LiH與H2O作用放出的H2用作電池燃料,若能量轉化率為80%,則導線中通過電子的物質的量為 mol。
(12分)工業上一般可采用如下反應來合成甲醇:
CO(g)+2H2(g)CH3OH(g) ΔH =-akJ·mol-1
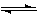
(1)上圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。
① a __0(填“>” “<” “=”)。
② 下列說法正確的是_ _(填序號)。
a.1 molCO(g) 和2 mol H2(g) 所具有的能量小于1 mol CH3OH(g) 所具有的能量
b.將1 molCO(g) 和2 mol H2(g) 置于一密閉容器中充分反應后放出a KJ的熱量
c.升高溫度,平衡向逆反應移動,上述熱化學方程式中的a值將減小
d.如將一定量CO(g) 和H2(g)置于某密閉容器中充分反應后放熱a KJ,則此過程中有1 mol CO(g) 被還原
(2)在一定條件下,科學家利用從煙道氣中分離出CO2與太陽能電池電解水產生的H2合成甲醇,其過程如下圖所示:
① 該合成路線對于環境保護的價值在于_ _。
② 15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱堿性,上述合成線路中用作CO2
吸收劑。用離子方程式表示乙醇胺水溶液呈弱堿性的原因:
。
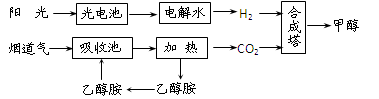
(3)甲醇燃料電池的工作原理如下左圖所示。該電池工作時,c口通入的物質發生的電極
反應式為:_ _。
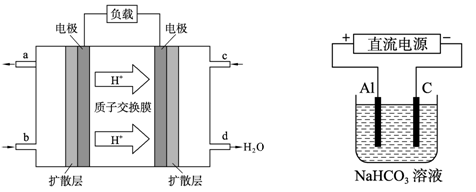
(4)以上述電池做電源,用上右圖所示裝置,在實驗室中模擬鋁制品表面“鈍化”處理的過程中,發現溶液逐漸變渾濁,原因是(用相關的電極反應式和離子方程式表示):
_ 。
(12分)工業上一般可采用如下反應來合成甲醇:
CO(g)+2H2(g)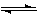 CH3OH(g) ΔH=-a kJ·mol-1
CH3OH(g) ΔH=-a kJ·mol-1
(1)上圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。
①a __0(填“>” “<” “=”)。
②下列說法正確的是_ _(填序號)。
a.1mol CO(g)和2mol H2(g)所具有的能量小于1mol CH3OH(g)所具有的能量
b.將1mol CO(g)和2mol H2(g)置于一密閉容器中充分反應后放出a KJ的熱量
c.升高溫度,平衡向逆反應移動,上述熱化學方程式中的a值將減小
d.如將一定量CO(g) 和H2(g)置于某密閉容器中充分反應后放熱aKJ,則此過程中有1molCO(g)被還原
(2)在一定條件下,科學家利用從煙道氣中分離出CO2與太陽能電池電解水產生的H2合成甲醇,其過程如下圖所示: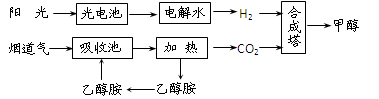
①該合成路線對于環境保護的價值在于_ _。
②15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱堿性,上述合成線路中用作CO2
吸收劑。用離子方程式表示乙醇胺水溶液呈弱堿性的原因:
。
(3)甲醇燃料電池的工作原理如下左圖所示。該電池工作時,c口通入的物質發生的電極
反應式為:_ _。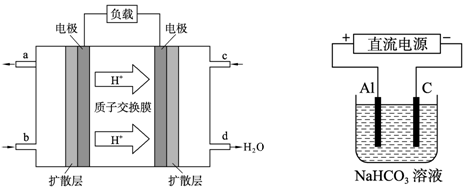
(4)以上述電池做電源,用上右圖所示裝置,在實驗室中模擬鋁制品表面“鈍化”處理的過程中,發現溶液逐漸變渾濁,原因是(用相關的電極反應式和離子方程式表示):
_ 。
(12分)工業上一般可采用如下反應來合成甲醇:
CO(g)+2H2(g) CH3OH(g)
ΔH =-a
kJ·mol-1
CH3OH(g)
ΔH =-a
kJ·mol-1

(1)上圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。
① a __0(填“>” “<” “=”)。
② 下列說法正確的是_ _(填序號)。
a.1 mol CO(g) 和2 mol H2(g) 所具有的能量小于1 mol CH3OH(g) 所具有的能量
b.將1 mol CO(g) 和2 mol H2(g) 置于一密閉容器中充分反應后放出a KJ的熱量
c.升高溫度,平衡向逆反應移動,上述熱化學方程式中的a值將減小
d.如將一定量CO(g) 和H2(g) 置于某密閉容器中充分反應后放熱a KJ,則此過程中有1 mol CO(g) 被還原
(2)在一定條件下,科學家利用從煙道氣中分離出CO2與太陽能電池電解水產生的H2合成甲醇,其過程如下圖所示:

① 該合成路線對于環境保護的價值在于_ _。
② 15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱堿性,上述合成線路中用作CO2
吸收劑。用離子方程式表示乙醇胺水溶液呈弱堿性的原因:
。
(3)甲醇燃料電池的工作原理如下左圖所示。該電池工作時,c口通入的物質發生的電極
反應式為:_ _。

(4)以上述電池做電源,用上右圖所示裝置,在實驗室中模擬鋁制品表面“鈍化”處理的過程中,發現溶液逐漸變渾濁,原因是(用相關的電極反應式和離子方程式表示):
_ 。
 CH3OH(g) ΔH=-a kJ·mol-1
CH3OH(g) ΔH=-a kJ·mol-1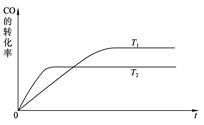
1.A(碘單質遇淀粉變藍色,而不是碘酸鉀)
2.D(同溫同壓下,mg氣體A與ng氣體B的分子數目相同,說明物質的量相同,A、B、C正確,D同溫同壓下,氣體A與氣體B的密度之比等于它們的物質的量之比為m : n)
3.C(從③處導出的氣體含有少量SO2、O2 、N2等,不可直接排入大氣,否則造成污染)
4.A(B項由于不知道氣體的狀態,
5.A(放出熱量ΔH<0,所以A錯誤;其它說法均正確)
6.A(水的熱穩定性比較高是因為水分子中氫氧鍵的鍵能大;金屬晶體導電是因為含有自由移動的電子;離子晶體硬度較大、難于壓縮是因為離子鍵鍵能大)
7.D (D中上下移動時,兩端液面始終平衡說明裝置漏氣)
8.B(過氧化鈉固體與水反應,是放熱反應,A、C錯誤;放熱使廣口瓶中氣體溫度升高膨脹,則右邊升高左邊下降)
9.A(ClO-+2I-+2H+===Cl-+I2+H2O;SO+I2+H2O===2I-+SO+2H+,所以可知氧化性為:ClO->I2>SO,因為②中加入過量的Na2SO3 溶液,所以③中含有BaSO3沉淀;①中硫酸只起到酸性作用,②只能證明SO有還原性)
10.C(二元弱酸應分步電離;草酸滴定KMnO4屬于氧化還原滴定,不用指示劑;乙二酸脫水分解產物是CO、CO2和H2O)
11.A((NH4)2SO4和CH3COOH明顯屬于電解質;Cl2是單質既不屬于電解質也不屬于非電解質;雖然NH3的水溶液能夠導電,那是由于生成了一水合氨的原因,故NH3屬于非電解質。)
12.D(CsCl和NaCl的陰、陽離子排列方式不同;金屬晶體中只有陽離子,沒有陰離子;分子晶體中不一定含有共價鍵如稀有氣體)
13.D(①說明有Br-、CO,有CO就沒有Fe2+②說明沒有SO③說明沒有I-)
14.D(能發生這兩個電極反應的可能是原電池,也可能是電解池,如果是原電池,則b為鐵電極,a為沒鐵活潑的金屬或非金屬做電極,電解溶液為含銅離子的溶液;如果是電解池,b用鐵做電極和電源的正極相連,a可以和鐵相同的電極也可以不同,溶液為含銅離子的溶液)
15.C(A稱量時應左物右碼,B配制150mL0.10mol/L溶液應用150mL的容量瓶,而且要用玻璃棒引流;D冷凝水的方向應從下進上出)
16.D(①所取濃硫酸的體積少,②③④均造成溶質的損失)
17.問題1:(1)合成氨工業 硫酸工業(其他合理答案也正確) (2分)
問題2:Cu+4H++2NO(濃)===Cu2++2NO2↑+2H2O
3Cu+8H++2NO(稀)===3Cu2++2NO↑+4H2O(其他合理答案也正確)(2分)
化學?第頁(見反面)問題3:放熱 C(金剛石、s)=C(石墨、s);ΔH=-1.90kJ/mol(2分)
問題4:(1)第二個反應為:Al3++3OH-===Al(OH)3↓ (2分)
(2)最后一個離子反應為:Al(OH)3+OH-===AlO+2H2O (2分)
問題5:4KMnO4+5KI+7H2SO4===4MnSO4+I2+3KIO3+3K2SO4+7H2O (2分) (其他合理答案也正確)
18.(1)①2Cl--2e-=Cl2↑(2分) 用濕潤的淀粉-KI試紙靠近Y極支管口(其它合理答案均可)(2分)
②由于2H++2e-=H2↑ 放出氫氣,使水的電離平衡向正反應方向移動,使c(OH-)不斷增大,所以pH會增大(2分)
③先有白色沉淀生成,繼而變成灰綠色,最后變成紅褐色(2分)
(2)①A(1分) ②B(1分)
19.(每空2分)(1)NaI NaClO
(2)2I-+ClO-+H2O===I2+Cl-+2OH- I2+5ClO-+2OH-===2IO+5Cl-+H2O
(3)Cl2+2NaOH===NaClO+NaCl+H2O
20.(1)KClO3 (1分) H????????H(1分)
(2)①關閉分液漏斗活塞,在II中加水,沒過長導管口,用酒精燈微熱圓底燒瓶,若II中有氣泡冒出,停止加熱后,有水進入II中的長導管,形成一段穩定的水柱,則證明I氣密性良好。 (或用止水夾夾住c處,向分液漏斗中加水,打分液漏斗的活塞,若分液漏斗中的水不再下流,則證明I氣密性良好。)(2分)
②MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
③S2-+Cl2===S↓+2 Cl-(2分)
化學?第頁 ④II III(1分) 除去氯氣中的水蒸氣(或干燥氯氣)(1分)
(3)Cl2+H2O2===2HCl+O2(2分)
21.(1)7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)C(NaCl)=1.8mol/L,Cl(NaClO)=0.8mol/L,C(NaClO3)=0.2mol/L (每個2分)
解析:解答此題的關鍵是第(1)問.可根據得失電子數相等確定生成物NaCl、NaClO、NaClO3的物質的量之比,進而確定化學方程式中化學計算數.
(1)依題意可設生成NaClO的物質的量為4mol,NaClO3的物質的量為1mol,設生成NaCl的物質的量x,根據得失電子的物質的量相等,有:1×x=1×4mol+5×1mol,解得:x=9mol.
NaCl、NaClO、NaClO3化學計量數之比與生成對應物質的物質的量相等,即等于9∶4∶1.據此可寫出總的化學字方程式:7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)n(Cl2)=
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com