題目列表(包括答案和解析)
在容器體積可變的密閉容器中,反應N
2(g)+3H
2(g)?2NH
3(g)在一定條件下達到平衡.
完成下列填空:
(1)若該反應經過2秒鐘后達到平衡,NH
3的濃度增加了0.6mol/L,在此期間,正反應速率v(H
2)的值為______
A.0.6mol/ B.0.45mol/
C.0.3mol/ D.0.2mol/
(2)在其他條件不變的情況下,縮小容器體積以增大反應體系的壓強,v
正______(選填“增大”、“減小”,下同),v
逆______,平衡向______方向移動(選填“正反應”、“逆反應”).
(3)在其他條件不變的情況下,降低溫度平衡向正反應方向移動,則正反應為______反應(選填“吸熱”、“放熱”).
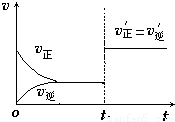
(4)如圖為反應速率(ν)與時間(t)關系的示意圖,由圖判斷,在t
1時刻曲線發生變化的原因是______(填寫編號).
a.增大N
2的濃度 b.擴大容器體積 c.加入催化劑 d.升高溫度
改變條件后,平衡混合物中NH
3的百分含量______(選填“增大”、“減小”、“不變”).
(5)若達到平衡時,n(N
2):n(H
2):n(NH
3)=2:2:1.保持溫度不變,以2:2:1的物質的量之比再充入N
2、H
2、NH
3,則______
A.平衡向正反應方向移動 B.平衡不移動
C.平衡時,NH
3的體積分數增大 D.平衡時,NH
3的體積分數可能減小.
查看答案和解析>>
在一容積為4L的密閉容器中,加入0.4mol的N
2和1.2mol的H
2,在一定條件下發生如下反應:N
2 (g)+3H
2 (g)═2NH
3 (g);△H<0,反應中NH
3的物質的量濃度變化情況如圖1:

(1)根據上圖,計算從反應開始到平衡時,平均反應速率v (NH
3)為
0.025
0.025
mol/(L?min).
(2)該反應的化學平衡常數表達式K
,隨溫度升高,K值將
減小
減小
(填“增大”、“減小”“不變”).
(3)反應達到平衡后,第5分鐘末,保持其它條件不變,若改變反應溫度,則NH
3的物質的量濃度不可能為
ac
ac
.
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(4)在一定條件下,合成氨反應已達化學平衡狀態的是
C、D、E
C、D、E
(填序號).
A.3v(H
2)
(正)=2v(NH
3)
(逆) B.混合氣體的密度保持不變
C.容器內壓強保持不變 D.條件一定,混合氣體的平均相對分子質量不再變化
E.單位時間內1mol N≡N鍵斷裂的同時,有3mol H-H鍵生成
F.單位時間內生成了n mol N
2的同時,減少了n mol NH
3(5)反應達到平衡后,第5分鐘末,保持其它條件不變,若只把容器的體積縮小一半,平衡
向正反應方向
向正反應方向
移動(填“向逆反應方向”、“向正反應方向”或“不”),化學平衡常數
不變
不變
(填“增大”、“減小”或“不變”).
(6)在第5分鐘末將容器的體積縮小一半后,若在第8分鐘末達到新的平衡(此時NH
3的濃度約為0.25mol/L),請在圖1中畫出第5分鐘末到此平衡時NH
3濃度的變化曲線.
(7)已知化學反應N
2+3H
2=2NH
3 的能量變化如圖2所示,
①1mol N 和3mol H 生成1mol NH
3(g)是
釋放
釋放
能量的過程(填“吸收”或“釋放”).
②
N
2(g)+
H
2(g)=NH
3(g);△H=
(a-b)kJ/mol
(a-b)kJ/mol
;
③N
2(g)和H
2生成NH
3(l)的熱化學方程式為
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.
查看答案和解析>>
在1L容積固定的密閉容器中進行A、B、C、D四種氣體間的反應,容器內各物質的物質的量隨時間的變化如下表:
| 時間/物質的量 |
n(A)(mol) |
n(B)(mol) |
n(C)(mol) |
n(D)(mol) |
| 起始 |
0.9 |
1.4 |
0 |
0.2 |
| 第1min |
0.6 |
1.1 |
0.15 |
|
| 第2min |
0.4 |
0.9 |
0.25 |
|
| 第3min |
0.3 |
0.8 |
|
0.8 |
| 第4min |
0.3 |
0.8 |
0.3 |
0.8 |
| 第5min |
0.35 |
0.85 |
0.275 |
0.75 |
根據以上信息回答下列問題:
(1)該反應的化學方程式為:
;
(2)反應到第2min時,用B表示的平均反應速率為
mol?L
-1?min
-1;
(3)反應到第3min時,A物質的轉化率為
;
(4)實驗表明升高溫度該反應的平衡常數K值會減小,則該反應為
反應(填“放熱”或“吸熱”),在第4min時改變了某一條件,該條件可能是
;
A.升溫 B.增加B的濃度 C.使用催化劑 D.通入稀有氣體
(5)下列能說明該反應達到平衡狀態的是
.
A.反應停止了 B.2v(B)
消耗=v(C)
消耗C.體系的密度保持不變 D.體系的壓強保持不變.
查看答案和解析>>
BCl
3是重要的化工原料,其沸點12℃.500℃時,向2L的密閉容器中按一定比例投入B
2O
3、C、Cl
2,模擬工業制取三氯化硼.
(1)配平模擬工業制取三氯化硼的反應方程式:
B
2O
3(s)+
C(s)+
Cl
2(g)?
BCl
3(g)+
CO(g)
(2)若上述反應轉移了0.3mol電子,則生成了
mol的BCl
3.
(3)反應至4min時達到平衡,則下列說法正確的是
.
A.3min時,CO的消耗速率大于氯氣的消耗速率
B.2min至4min時BCl
3的生成速率比0至2min時的快
C.反應起始至平衡,氣體的密度不斷增大
D.達到平衡后,容器內的壓強不再變化.
(4)達到平衡后,若向容器內加入少量的B
2O
3,則氯氣的轉化率將
(填:增大、減小、不變);若提高反應體系的溫度,容器內的氣體平均分子量減小,則該反應為
(填:“吸”、“放”)熱反應.
(5)若要提高單位時間內BCl
3的產量,且保持平衡常數不變,下列做法正確的是
.
A. 增大反應容器的體積
B.將混合氣體經冰水浴冷卻后,再將氣體升溫至500℃循環進入反應容器
C.加入適當的催化劑
D.升高反應體系的溫度.
(6)反應起始至3min時固體質量減少了15.84克,則氯氣的平均反應速率為
.
查看答案和解析>>
T ℃時,在2 L密閉容器中使X(g)與Y(g)發生反應生成Z(g)。反應過程中X、Y、Z的濃度變化如圖1所示;若保持其他條件不變,溫度分別為T1和T2時,Y的體積百分含量與時間的關系如圖2所示。則下列結論不正確的是

A.容器中發生的反應可表示為:3X(g)+Y(g)  2Z(g)
2Z(g)
B.反應進行的前3 min內,用X表示的反應速率 v(X)=0.3mol/(L·min)
C.保持其他條件不變,升高溫度,反應的化學平衡常數K增大
D.若改變反應條件,使反應進程如圖3所示,則改變的條件可能是使用了催化劑
查看答案和解析>>
命題人:李孝平 審題人:李白仲
一、二選擇題:(1―10題每題2分,11-18每題3分,共44分)
題 號
1
2
3
4
5
6
7
8
9
10
答 案
B
D
A
B
D
C
C
B
B
C
題 號
11
12
13
14
15
16
17
18
|
答 案 D B B C C D A A |
三、填空題:(本題共5小題,共46分)
19、①、③、⑧; ②、④; ⑤;
⑥、⑦;(每空1分)
20、(1) 略 3分 ;(2)略 4分
(3)c3>c1>c2;CH3COOH; D。(各2分)
21、(1)、4;(2分) (2)、大于(1分);因為升溫水的電離平衡右移,離子濃度增大,Kw增大;(2分)
22、(1)H-O-O-H(2分) (2)N2H4(l)+H2O2(l)
== N2(g) +2H2O(l)
△H=-644.25
KJ/mol(3分)(3)產物不會造成環境污染。(1分)
23、(10分)(1)1 (2分) (2)否、(2分) 大于(1分) 因為
試卷.files/image027.gif)
試卷.files/image029.jpg)
試卷.files/image031.jpg)
= = <K平衡向右移動(3分)
(3)增大 減小(各1分)
24、(1)加快 (2)D (3)40% 試卷.files/image033.gif) L (各2分)
L (各2分)
25、(10分)⑴、反應產生氣泡快慢或反應完成的先后或試管壁的冷熱程度 ;
控制陰離子相同,排除陰離子的干擾 ; 將FeCl3改為Fe2(SO4)3
⑵、關閉A處活塞,將注射器活塞拉出一定距離,一段時間后松開活塞,觀察活塞是否回到原位 一定時間內收集到的氣體體積或收集一定體積的氣體所需要的時間 ( 合理答案同樣給分) 各2分




 2Z(g)
2Z(g)試卷.files/image027.gif)
試卷.files/image029.jpg)
試卷.files/image031.jpg)
試卷.files/image033.gif) L (各2分)
L (各2分)