
題目列表(包括答案和解析)
白菜中含有鈣鐵等元素,某化學(xué)小組設(shè)計如下方案測定干白菜中鈣元素的質(zhì)量分數(shù)。首先取10.00g干白菜葉,灼燒得白菜灰粉進行下列實驗:

(1)實驗前要先將干白菜葉樣品高溫灼燒成灰粉,其主要目的是使樣品中的有機物完全分解,使干白菜葉中的鈣、鐵元素溶解完全,灼燒用到的部分儀器有
A.坩堝 B.蒸發(fā)皿 C.玻璃棒 D.泥三角
(2)寫出從濾液A→沉淀D的離子反應(yīng)方程式 。
(3)用KMnO4標準溶液滴定濾液C:先將濾液C稀釋至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.100 0 mol·L-1’的KMnO4標準溶液滴定,終點時消耗KMnO4溶液10.00mL。
發(fā)生的反應(yīng)為:
①滴定的過程中,同學(xué)們發(fā)現(xiàn)一個現(xiàn)象:向C溶液中加入第一滴KMnO4溶液時,需要振搖錐形瓶較長時間才能褪色,當(dāng)溶液褪色后,再滴入KMnO4溶液,則迅速褪色,直至達到終點;為了加快滴入第一滴KMnO4溶液時的褪色速度,可采取的方法是 .(選擇合適的選項)
A.適當(dāng)加熱錐形瓶內(nèi)溶液 B.在錐形瓶內(nèi)加少量水
C.在錐形瓶內(nèi)加適量乙醇 D.在錐形瓶內(nèi)加入幾滴MnSO4溶液
②判斷滴定達到終點的方法是 。
(4)原干白菜葉中鈣元素的質(zhì)量分數(shù)為 。
(5)為保證實驗精確度,沉淀D及E需要分別洗滌,并將洗滌液轉(zhuǎn)移回母液中,試判斷沉淀D已經(jīng)洗滌干凈的方法是 。如果沉淀E未洗滌,或未將洗滌液轉(zhuǎn)移回母液,則測得的鈣元素質(zhì)量分數(shù) (填“偏高”“偏低”或“無影響”)。
白菜中含有鈣鐵等元素,某化學(xué)小組設(shè)計如下方案測定干白菜中鈣元素的質(zhì)量分數(shù)。首先取10.00g干白菜葉,灼燒得白菜灰粉進行下列實驗: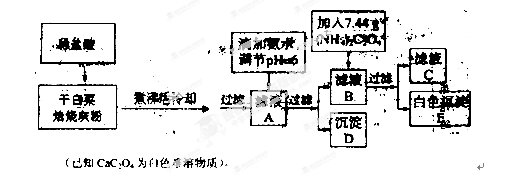
(1)實驗前要先將干白菜葉樣品高溫灼燒成灰粉,其主要目的是使樣品中的有機物完全分解,使干白菜葉中的鈣、鐵元素溶解完全,灼燒用到的部分儀器有
A.坩堝 B.蒸發(fā)皿 C.玻璃棒 D.泥三角
(2)寫出從濾液A→沉淀D的離子反應(yīng)方程式 。
(3)用KMnO4標準溶液滴定濾液C:先將濾液C稀釋至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.100 0 mol·L-1’的KMnO4標準溶液滴定,終點時消耗KMnO4溶液10.00mL。
發(fā)生的反應(yīng)為:
①滴定的過程中,同學(xué)們發(fā)現(xiàn)一個現(xiàn)象:向C溶液中加入第一滴KMnO4溶液時,需要振搖錐形瓶較長時間才能褪色,當(dāng)溶液褪色后,再滴入KMnO4溶液,則迅速褪色,直至達到終點;為了加快滴入第一滴KMnO4溶液時的褪色速度,可采取的方法是 .(選擇合適的選項)
A.適當(dāng)加熱錐形瓶內(nèi)溶液 B.在錐形瓶內(nèi)加少量水
C.在錐形瓶內(nèi)加適量乙醇 D.在錐形瓶內(nèi)加入幾滴MnSO4溶液
②判斷滴定達到終點的方法是 。
(4)原干白菜葉中鈣元素的質(zhì)量分數(shù)為 。
(5)為保證實驗精確度,沉淀D及E需要分別洗滌,并將洗滌液轉(zhuǎn)移回母液中,試判斷沉淀D已經(jīng)洗滌干凈的方法是 。如果沉淀E未洗滌,或未將洗滌液轉(zhuǎn)移回母液,則測得的鈣元素質(zhì)量分數(shù) (填“偏高”“偏低”或“無影響”)。

實驗室用銅制取硫酸銅,將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應(yīng)完全,通過蒸發(fā)、結(jié)晶得到硫酸銅晶體。
(1)為了節(jié)約原料,硫酸和硝酸的物質(zhì)的量之比最佳為: ;為了吸收該反應(yīng)中產(chǎn)生的尾氣,請選擇下列中合適的裝置 。
(2)為符合綠色化學(xué)的要求,某研究性學(xué)習(xí)小組進行如下設(shè)計:
第一組:以空氣為氧化劑法
方案1:以空氣為氧化劑。將銅粉在儀器B中反復(fù)灼燒,使銅與空氣充分反應(yīng)生成氧化銅,再將氧化銅與稀硫酸反應(yīng)。
方案2:將空氣或氧氣直接通入到銅粉與稀硫酸的混合物中,發(fā)現(xiàn)在常溫下幾乎不反應(yīng)。向反應(yīng)液中加少量FeSO4,即發(fā)生反應(yīng),生成硫酸銅。反應(yīng)完全后,加物質(zhì)甲調(diào)節(jié)pH ,鐵元素全部沉淀(一般認為鐵離子的濃度下降到10-5 mol·L-1,就認為沉淀完全),然后過濾、濃縮、結(jié)晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
請回答下列問題:
如開始加入的銅粉為3.2 g,最后所得溶液為500 mL,溶液中含有鐵元素0.005 mol。
①方案1中的B儀器名稱是 。
②為了使鐵元素全部沉淀,應(yīng)調(diào)節(jié)pH至少為_________。
③方案2中甲物質(zhì)可選用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反應(yīng)中加入少量FeSO4可加速銅的氧化,用離子方程式解釋其原因 。
第二組:過氧化氫為氧化劑法
將3.2g銅絲放到45 mL 1.5mol·L-1的稀硫酸中,控溫在50℃。加入18mL 10%的H2O2,反應(yīng)0.5h,升溫到60℃,持續(xù)反應(yīng)1 h后,過濾、蒸發(fā)濃縮、減壓抽濾等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.5g。
請回答下列問題:
⑤反應(yīng)時溫度控制在50℃~60℃不宜過高的原因是 ,
⑥本實驗CuSO4·5H2O的產(chǎn)率為 。
實驗室用銅制取硫酸銅,將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應(yīng)完全,通過蒸發(fā)、結(jié)晶得到硫酸銅晶體。
(1)為了節(jié)約原料,硫酸和硝酸的物質(zhì)的量之比最佳為: ;為了吸收該反應(yīng)中產(chǎn)生的尾氣,請選擇下列中合適的裝置 。

(2)為符合綠色化學(xué)的要求,某研究性學(xué)習(xí)小組進行如下設(shè)計:
第一組:以空氣為氧化劑法
方案1:以空氣為氧化劑。將銅粉在儀器B中反復(fù)灼燒,使銅與空氣充分反應(yīng)生成氧化銅,再將氧化銅與稀硫酸反應(yīng)。
方案2:將空氣或氧氣直接通入到銅粉與稀硫酸的混合物中,發(fā)現(xiàn)在常溫下幾乎不反應(yīng)。向反應(yīng)液中加少量FeSO4,即發(fā)生反應(yīng),生成硫酸銅。反應(yīng)完全后,加物質(zhì)甲調(diào)節(jié)pH ,鐵元素全部沉淀(一般認為鐵離子的濃度下降到10-5 mol·L-1,就認為沉淀完全),然后過濾、濃縮、結(jié)晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
請回答下列問題:
如開始加入的銅粉為3.2 g,最后所得溶液為500 mL,溶液中含有鐵元素0.005 mol。
①方案1中的B儀器名稱是 。
②為了使鐵元素全部沉淀,應(yīng)調(diào)節(jié)pH至少為_________。
③方案2中甲物質(zhì)可選用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反應(yīng)中加入少量FeSO4可加速銅的氧化,用離子方程式解釋其原因 。
第二組:過氧化氫為氧化劑法
將3.2g銅絲放到45 mL 1.5mol·L-1的稀硫酸中,控溫在50℃。加入18mL 10%的H2O2,反應(yīng)0.5h,升溫到60℃,持續(xù)反應(yīng)1 h后,過濾、蒸發(fā)濃縮、減壓抽濾等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
請回答下列問題:
⑤反應(yīng)時溫度控制在50℃~60℃不宜過高的原因是 ,
⑥本實驗CuSO4·5H2O的產(chǎn)率為 。
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com