
題目列表(包括答案和解析)
(18分)為有效控制霧霾,各地積極采取措施改善大氣質量,研究并有效控制空氣中的氮氧化物、碳氧化物和硫氧化物含量顯得尤為重要。
(1)汽車內燃機工作時會引起N2和O2的反應:N2(g)+O2(g) 2NO(g),是導致汽車尾氣中含有NO的原因之一。
2NO(g),是導致汽車尾氣中含有NO的原因之一。
①在T1、T2溫度下,一定量的NO發生分解反應時N2的體積分數隨時間變化如圖所示,根據圖像判斷反應N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。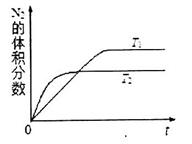
②在T3溫度下,向2L密閉容器中充入10molN2與5mo1O2,50秒后達到平衡,測得NO的物質的量為2mol,則該反應的速率v (N2)=___________________。該溫度下,若開始時向上述容器中充入N2與O2均為1 mol,則達到平衡后N2的轉化率為____________。
(2)利用下圖所示裝置(電極均為惰性電極)可吸收SO2,用陰極排出的溶液可吸收NO2。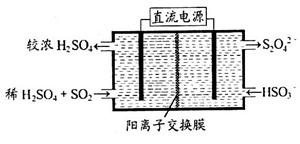
①陽極的電極反應式為_____________________。
②在堿性條件下,用陰極排出的溶液吸收NO2,使其轉化為無害氣體,同時有SO32—生成。該反應中氧化劑與還原劑的物質的量之比為_______________。
(3)一定條件下可用甲醇與CO反應生成醋酸消除CO污染。常溫下,將a mol·L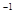 的醋酸與b mol
的醋酸與b mol L
L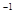 Ba(OH)2溶液等體積混合,充分反應后,溶液中存在2c(Ba2+)=c(CH3COO-),則該混合溶液中醋酸的電離常數Ka=______________________(用含a和b的代數式表示)。
Ba(OH)2溶液等體積混合,充分反應后,溶液中存在2c(Ba2+)=c(CH3COO-),則該混合溶液中醋酸的電離常數Ka=______________________(用含a和b的代數式表示)。
| 物質 | CO | H2 | CH3OH |
| 濃度(mol?L-1) | 0.9 | 1.0 | 0.6 |
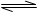 2NH3(g)的△H= 。
2NH3(g)的△H= 。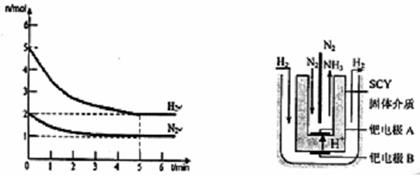
| | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 |
無機化學反應式
1、2Na+2H2O=2NaOH+H2↑ ★ 2K+2H2O=2KOH+H2↑
2、2Na2O2+2H2O=4NaOH+O2↑ 3、2Na2O2+2CO2=2Na2CO3+O2
4、氫氧化鈉和碳酸氫鈉在溶液中反應的離子方程式為:
OH- +HCO3- =CO32- +H2O
氯氣溶于水(新制氯水中含Cl2.HClO.H2O .H+ .Cl - .ClO - .OH-):
5、Cl2+H2O=HCl+HClO ★ Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸見光分解(強氧化劑、殺菌消毒,漂白劑):
6、2HClO![]() 2HCl+O2↑
2HCl+O2↑
7、Ca(ClO)2+CO2+H2O=CaCO3+2HClO
8、MnO2+4HCl(濃) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
9、2F2+2H2O=4HF+O2 Cl2+H2O=HCl+HClO Br2+H2O=HBr+HBrO
10、2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2NaOH=2NaAlO2+H2O
Al(OH)3+NaOH=NaAlO2+2H2O
11、H2O2的分解: 2H2O2![]() 2H2O+O2↑ *H2S與SO2的反應: 2H2S+SO2=3S+2H2O
2H2O+O2↑ *H2S與SO2的反應: 2H2S+SO2=3S+2H2O
12、2SO2+O2![]() 2SO3
2SO3
13、Cu+2H2SO4(濃) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
14、C+2H2SO4(濃) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
15、SiO2+2C![]() Si+2CO↑
Si+2CO↑
16、![]()
17、N2+O2 ![]() 2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
2NO 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
18、4NH3 +5O2 4NO+6H2O
4NO+6H2O
19、用濃鹽酸檢驗氨氣(白煙生成): NH3+HCl=NH4Cl
20、(NH4)2SO4+2NaOH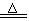 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
21、NH4NO3+NaOH=NaNO3+NH3↑+H2O
22、4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
23、Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C+4HNO3(濃)=CO2↑+4NO2↑+2H2O
24、FeCl3+3KSCN![]() 3KCl+Fe(SCN)3
3KCl+Fe(SCN)3
25、鹽類水解: CH3COO- +H2O![]() CH3COOH+OH- CO32- +H2O
CH3COOH+OH- CO32- +H2O![]() HCO3-+OH-
HCO3-+OH-
HCO3- +H2O![]() H2CO3+OH- NH4+ +H2O
H2CO3+OH- NH4+ +H2O![]() NH3?H2O+H+
NH3?H2O+H+
Fe3+ +3H2O![]() Fe(OH)3+3H+
Fe(OH)3+3H+
27、鋁熱反應: 2Al+Fe2O3![]() 2Fe+Al2O3
2Fe+Al2O3
4Al+3MnO2![]() 3Mn+2Al2O3
3Mn+2Al2O3
28、2Mg+CO2![]() C+2MgO
C+2MgO
29、Al2(SO4)3+6NH3·¤H2O=2Al(OH)3↓?+2(NH4)2SO4
30、NaAlO2+HCl+H2O=Al(OH)3↓? +NaCl ; NaAlO2+CO2+H2O=Al(OH)3↓? +NaHCO3
31、高溫下鐵與水反應 :3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
32、FeCl3+3NaOH=Fe(OH)3↓?+3NaCl
33、4Fe(OH)2+O2+2H2O=4Fe(OH)3
34、2FeCl2+Cl2=2FeCl3 2FeCl3+Fe=3FeCl2
35、氯化鐵溶液中加入銅粉: 2FeCl3+Cu=2FeCl2+CuCl2
36、金屬的冶煉:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
CuO+C![]() Cu+CO↑
Cu+CO↑
![]()
37、銅鋅原電池:正極:2H++2e- =H2↑
負極:Zn-2e- =Zn2+
38、鋼鐵的吸氧腐蝕:正極:O2+4e- +2H2O=4OH-
負極:Fe-2e- =Fe2+
39、Fe(OH)3膠體的制取:FeCl3 +3H2O Fe(OH)3(膠體)+3HCl
Fe(OH)3(膠體)+3HCl
40、電解CuCl2溶液:陽極:2Cl- -2e- =Cl2↑
陰極:Cu2++2e- =Cu
總反應:CuCl2![]() Cu+Cl2↑
Cu+Cl2↑
41、銅的電解精煉:陽極:Cu-2e- =Cu2+
陰極:Cu2++2e- =Cu
42、電鍍銅:陽極:Cu-2e- =Cu2+
陰極:Cu2++2e- =Cu
43、電解飽和食鹽水:陽極:2Cl- +2e-=Cl2↑
陰極:2H+ +2e- =H2↑
總反應:2NaOH+2H2O![]() H2↑+2NaOH+Cl2↑
H2↑+2NaOH+Cl2↑
44、黃鐵礦的燃燒: 4FeS2 +11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
45、氨水吸收少量SO2: SO2+2NH3 +H2O=(NH4)2SO3
46、C+H2O(g)![]() CO+H2
CO+H2
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com