
題目列表(包括答案和解析)
下列
物質①Cu
②液態SO2
③純醋酸
④NaHCO3
⑤Ba(OH)2溶液
Ⅰ、屬于非電解質的是________;(填序號)
Ⅱ、(1)NaHCO3是一種________(填“強”或“弱”)電解質;
(2)寫出HCO3―水解的離子方程式:________;
(3)常溫下,0.1 mol·L-1 NaHCO3溶液的pH大于8,則溶液中Na+、HCO3―、H2CO3、CO32―、OH-五種微粒的濃度由大到小的順序為:________.
(4)常溫常壓下,空氣中的CO2溶于水,達到平衡時,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1.若忽略水的電離及H2CO3的第二級電離,則H2CO3 HCO3-+H+的平衡常數K1=________.(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常數K1=________.(已知:10-5.60=2.5×10-6)
Ⅲ、Ba(OH)2是一種強電解質,現有25℃、pH=13的Ba(OH)2溶液.
(1)該Ba(OH)2溶液的物質的量濃度為________;
(2)溶液中由水電離出c(OH―)=________;
(3)與某濃度鹽酸溶液按體積比(堿與酸之比)1∶9混合后,所得溶液pH=11(假設混合溶液的體積等于混合前兩溶液的體積和),該鹽酸溶液的pH=________.
Ⅳ、醋酸是一種弱電解質.
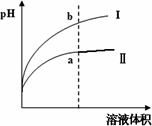
某溫度下,相同pH值的鹽酸和醋酸溶液分別加水稀釋,平衡pH值隨溶液體積變化的曲線如下圖所示.則圖________(填“Ⅰ”或“Ⅱ”)為醋酸稀釋的圖像.
下表是幾種弱電解質的電離平衡常數、難溶電解質的溶度積Ksp(25℃)。
|
電解質 |
電離方程式 |
電離常數K |
Ksp |
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
- |
|
C6H5OH |
C6H5OH |
1.1×10-10 |
- |
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 |
- |
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
- |
|
BaSO4 |
BaSO4(s) |
- |
1.07×10-10 |
回答下列問題:
(1)寫出C6H5OH與Na3PO4反應的離子方程式:_________________。
(2)25℃時,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子濃度關系正確的是__________(填序號)。
a.若混合液pH>7,則V≥10
b.V=5時,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10時,混合液中水的電離程度小于0.01 mol C6H5OH溶液中水的電離程度
C6H5OH溶液中水的電離程度
d.若混合液pH<7,則c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反應的化學平衡常數稱為水解常數(用Kb表示),類比化學平衡常數的定義。25℃時,Na2CO3第一步水解反應的水解常數Kb=____mol/L。
(4)如圖所示,有T1、T2不同溫度下兩條BaSO4在水中的沉淀溶解平衡曲線(已知BaSO4的Ksp隨溫度升高而增大)。
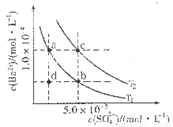
①T2____ 25℃(填“>”、“<”或“=”);
②討論T1溫度時BaSO4的沉淀溶解平衡曲線,下列說法正確的是____(填序號)。
a.加入Na2SO4不能使溶液由a點變為b點
b.在T1曲線上方區域(不含曲線)任意一點時,均有BaSO4沉淀生成
c.蒸發溶劑可能使溶液由d點變為曲線上a、b之間的某一點(不含a、b)
d.升溫可使溶液由b點變為d點
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com