
題目列表(包括答案和解析)
醋酸是日常生活中最常見的調味劑和重要的化工原料,醋酸鈉是其常見的鹽。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 請回答:
⑴ 寫出醋酸鈉在水中發生水解反應的離子方程式: ;
⑵ 在CH3COONa溶液中離子濃度由大到小的順序為
(用“c(Bn+)”表示相應離子濃度);
⑶ 25℃時,醋酸的電離平衡常數表達式Ka= 。0.10mol/L的醋酸溶液的pH約為 (提示:醋酸的電離常數很小,平衡時的c(CH3COOH)
可近似視為仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 對于醋酸溶液和醋酸鈉溶液的下列說法正確的是
A.稀釋醋酸溶液,醋酸的電離程度增大,而稀釋醋酸鈉溶液則醋酸鈉的水解程度減小。
升高溫度可以促進醋酸電離,而升高溫度則會抑制醋酸鈉水解。
C.醋酸和醋酸鈉的混合液中,醋酸抑制醋酸鈉的水解、醋酸鈉也抑制醋酸的電離。
D.醋酸和醋酸鈉的混合液中,醋酸促進醋酸鈉的水解、醋酸鈉也促進醋酸的電離。
⑸ 物質的量濃度均為0.1mol/L的CH3COONa和CH3COOH溶液等體積混合(注:混合前后溶液體積變化忽略不計),混合液中的下列關系式正確的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常溫時,有以下3種溶液,其中pH最小的是

⑺ 已知醋酸能![]() 夠和小蘇打溶液發生下列反應:
夠和小蘇打溶液發生下列反應:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH試紙在常溫下分別測定![]() 0.10mol/L的醋酸鈉溶液和0.10mol/L的碳酸氫鈉溶液,
0.10mol/L的醋酸鈉溶液和0.10mol/L的碳酸氫鈉溶液,
則pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
醋酸是日常生活中最常見的調味劑和重要的化工原料,醋酸鈉是其常見的鹽。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 請回答:
⑴ 寫出醋酸鈉在水中發生水解反應的離子方程式: ;
⑵ 在CH3COONa溶液中離子濃度由大到小的順序為
(用“c(Bn+)”表示相應離子濃度);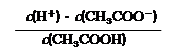
⑶ 25℃時,醋酸的電離平衡常數表達式Ka= 。0.10mol/L的醋酸溶液的pH約為 (提示:醋酸的電離常數很小,平衡時的c(CH3COOH)
可近似視為仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 對于醋酸溶液和醋酸鈉溶液的下列說法正確的是
A.稀釋醋酸溶液,醋酸的電離程度增大,而稀釋醋酸鈉溶液則醋酸鈉的水解程度減小。
升高溫度可以促進醋酸電離,而升高溫度則會抑制醋酸鈉水解。
C.醋酸和醋酸鈉的混合液中,醋酸抑制醋酸鈉的水解、醋酸鈉也抑制醋酸的電離。
D.醋酸和醋酸鈉的混合液中,醋酸促進醋酸鈉的水解、醋酸鈉也促進醋酸的電離。
⑸ 物質的量濃度均為0.1mol/L的CH3COONa和CH3COOH溶液等體積混合(注:混合前后溶液體積變化忽略不計),混合液中的下列關系式正確的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常溫時,有以下3種溶液,其中pH最小的是
⑺ 已知醋酸能夠和小蘇打溶液發生下列反應:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
用pH試紙在常溫下分別測定0.10mol/L的醋酸鈉溶液和0.10mol/L的碳酸氫鈉溶液,
則pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
醋酸是日常生活中最常見的調味劑和重要的化工原料,醋酸鈉是其常見的鹽。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 請回答:
⑴寫出醋酸鈉在水中發生水解反應的離子方程式: ;
⑵在CH3COONa溶液中離子濃度由大到小的順序為
(用“c(Bn+)”表示相應離子濃度);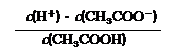
⑶ 25℃時,醋酸的電離平衡常數表達式Ka= 。0.10mol/L的醋酸溶液的pH約為 (提示:醋酸的電離常數很小,平衡時的c(CH3COOH)
可近似視為仍等于0.10mol/L;已知:lg1.3=0.114);
⑷對于醋酸溶液和醋酸鈉溶液的下列說法正確的是
A.稀釋醋酸溶液,醋酸的電離程度增大,而稀釋醋酸鈉溶液則醋酸鈉的水解程度減小。
升高溫度可以促進醋酸電離,而升高溫度則會抑制醋酸鈉水解。
C.醋酸和醋酸鈉的混合液中,醋酸抑制醋酸鈉的水解、醋酸鈉也抑制醋酸的電離。
D.醋酸和醋酸鈉的混合液中,醋酸促進醋酸鈉的水解、醋酸鈉也促進醋酸的電離。
⑸物質的量濃度均為0.1mol/L的CH3COONa和CH3COOH溶液等體積混合(注:混合前后溶液體積變化忽略不計),混合液中的下列關系式正確的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹常溫時,有以下3種溶液,其中pH最小的是
⑺已知醋酸能 夠和小蘇打溶液發生下列反應:
夠和小蘇打溶液發生下列反應:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH試紙在常溫下分別測定 0.10mol/L的醋酸鈉溶液和0.10mol/L的碳酸氫鈉溶液,
0.10mol/L的醋酸鈉溶液和0.10mol/L的碳酸氫鈉溶液,
則pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
醋酸是日常生活中最常見的調味劑和重要的化工原料,醋酸鈉是其常見的鹽。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 請回答:
⑴ 寫出醋酸鈉在水中發生水解反應的離子方程式: ;
⑵ 在CH3COONa溶液中離子濃度由大到小的順序為
⑶ 25℃時,醋酸的電離平衡常數表達式Ka= 。0.10mol/L的醋酸溶液的pH約為 (提示:醋酸的電離常數很小,平衡時的c(CH3COOH)
可近似視為仍等于0.10mol/L; 已知:lg1.3=0.114);
⑷ 對于醋酸溶液和醋酸鈉溶液的下列說法正確的是
A.稀釋醋酸溶液,醋酸的電離程度增大,而稀釋醋酸鈉溶液則醋酸鈉的水解程度減小。
升高溫度可以促進醋酸電離,而升高溫度則會抑制醋酸鈉水解。
C.醋酸和醋酸鈉的混合液中,醋酸抑制醋酸鈉的水解、醋酸鈉也抑制醋酸的電離。
D.醋酸和醋酸鈉的混合液中,醋酸促進醋酸鈉的水解、醋酸鈉也促進醋酸的電離。
⑸ 物質的量濃度均為0.1mol/L的CH3COONa和CH3COOH溶液等體積混合(注:混合前后溶液體積變化忽略不計),混合液中的下列關系式正確的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹ 常溫時,有以下3種溶液,其中pH最小的是

⑺ 已知醋酸能夠和小蘇打溶液發生下列反應:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH試紙在常溫下分別測定0.10mol/L的醋酸鈉溶液和0.10mol/L的碳酸氫鈉溶液,
則pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
研究CO2的利用對促進低碳社會的構建具有重要的意義。
(1)將CO2與焦炭作用生成CO,CO可用于煉鐵等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
則CO還原Fe2O3的熱化學方程式為___________________________
②利用燃燒反應可設計成CO/O2燃料電池(以KOH溶液為電解液),寫出該電池的負極反應式___________________________________________
(2)某實驗將CO2和H2充入一定體積的密閉容器中,在兩種不同條件下反應:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
測得CH3OH的物質的量隨時間變化如上圖所示,回答問題:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
| A.升高溫度 | B.充入He(g)使體系壓強增大 |
| C.將H2O(g)從體系中分離 | D.再充入1 mol CO2和3 mol H2 |
| 容器 | 甲 | 乙 |
| 反應物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
 ,要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持反應逆向進行,則c的取值范圍為________。
,要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持反應逆向進行,則c的取值范圍為________。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com