
題目列表(包括答案和解析)
鹵素單質的性質活潑,鹵素的化合物應用廣泛,研究鹵素單質及其化合物具有重要意義。
(1)近年來,各地報刊紛紛轉載了不要將不同品牌潔污劑混合使用的警告。據報道,在全國各地發生了多起混合潔污劑發生氯氣中毒的事件。根據你的化學知識作出如下判斷:
當事人使用的液態潔污劑之一必定含氯,最可能的存在形式是 和 。當另一種具有 (性質)的液態潔污劑與之混合,可能發生如下反應而產生氯氣:
。
(2)次氯酸鹽的氧化性較強,可在堿性環境中將許多物質氧化,例如可用其將Fe3+氧化為新型殺菌消毒劑FeO42-,寫出該反應的離子方程式 。
(3)碘鎢燈具有比白熾燈壽命長且環保節能的特點。一定溫度下,燈泡內封存的少量碘與使用過程中沉積在管壁上的鎢可以發生反應:
W(s)+I2(g)![]() WI2(g)。為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL的密閉容器中, 加熱使其反應。
WI2(g)。為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL的密閉容器中, 加熱使其反應。
如圖是WI2(g)的物質的量隨時間變化關系圖象,其中曲線I(0~t2時間段)的反應溫度為T1,曲線II(從t2開始)的反應溫度為T2,且T2>T1。ks*5*u
|
|
|
|

則:①該反應的△H 0(填“>” 或“=”或“<”)
②從反應開始到t1時間內的平均反應速率v(I2)= 。
③下列說法中不正確的是 (填序號)。
A.該反應的平衡常數表達式是![]()
B.燈絲附近溫度越高,燈絲附近區域WI2越易變為W而重新沉積到燈絲上
C.利用該反應原理可以提純鎢
(4)25℃時,向5mL含有KCl和KI濃度均為0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中離子濃度由大到小的順序是 。
[不考慮H+和OH-。25℃時KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提純Ti的試劑,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
請寫出Mg與液態TiCl4反應提純鈦的熱化學方程式 。
鹵素單質的性質活潑,鹵素的化合物應用廣泛,研究鹵素單質及其化合物具有重要意義。
(1)近年來,各地報刊紛紛轉載了不要將不同品牌潔污劑混合使用的警告。據報道,在全國各地發生了多起混合潔污劑發生氯氣中毒的事件。根據你的化學知識作出如下判斷:
當事人使用的液態潔污劑之一必定含氯,最可能的存在形式是 和 。當另一種具有 (性質)的液態潔污劑與之混合,可能發生如下反應而產生氯氣:
。
(2)次氯酸鹽的氧化性較強,可在堿性環境中將許多物質氧化,例如可用其將Fe3+氧化為新型殺菌消毒劑FeO42-,寫出該反應的離子方程式 。
(3)碘鎢燈具有比白熾燈壽命長且環保節能的特點。一定溫度下,燈泡內封存的少量碘與使用過程中沉積在管壁上的鎢可以發生反應:
W(s)+I2(g)![]() WI2(g)。為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL的密閉容器中, 加熱使其反應。
WI2(g)。為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL的密閉容器中, 加熱使其反應。
如圖是WI2(g)的物質的量隨時間變化關系圖象,其中曲線I(0~t2時間段)的反應溫度為T1,曲線II(從t2開始)的反應溫度為T2,且T2>T1。
|
|
|
|
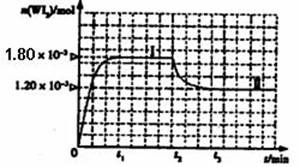
則:①該反應的△H 0(填“>” 或“=”或“<”)
②從反應開始到t1時間內的平均反應速率v(I2)= 。
③下列說法中不正確的是 (填序號)。
A.該反應的平衡常數表達式是![]()
B.燈絲附近溫度越高,燈絲附近區域WI2越易變為W而重新沉積到燈絲上
C.利用該反應原理可以提純鎢
(4)25℃時,向5mL含有KCl和KI濃度均為0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液后,溶液中離子濃度由大到小的順序是 。
[不考慮H+和OH-。25℃時KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(5)Mg常用作提純Ti的試劑,已知:
①Mg(s)+Cl2(g)=MgCl2(s) △H= —641kJ/mol ②Ti(s)+2Cl2(g)=TiCl4(l) △H= —770kJ/mol
請寫出Mg與液態TiCl4反應提純鈦的熱化學方程式 。
(11分)以CO2為碳源制取低碳有機物成為國際研究焦點,下面為CO2加氫制取低碳醇的熱力學數據:
反應I: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1
反應II:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H =" —173.6" kJ·mol-1
CH3CH2OH(g)+3H2O(g) △H =" —173.6" kJ·mol-1
(1)寫出由CH3CH2OH+_____ 2CH3OH的熱化學方程式為:__________________。
2CH3OH的熱化學方程式為:__________________。
(2)在一定條件下,對于反應I:在體積恒定的密閉容器中,達到平衡的標志是__ (填字母)
a.CO2和CH3OH 濃度相等 b.H2O的百分含量保持不變
c.H2的平均反應速率為0 d.v正(CO2)=3v逆(H2)
e.混合氣體的密度不再發生改變
f. 混合氣體的平均相對分子質量不再發生改變
如果平衡常數K值變大,該反應 (填字母)
a.一定向正反應方向移動 b.在平衡移動時正反應速率先增大后減小
c.一定向逆反應方向移動 d.在平衡移動時逆反應速率先減小后增大
其他條件恒定,如果想提高CO2的反應速率,可以采取的反應條件是 (填字母) ,
達到平衡后,想提高H2轉化率的是_______________(填字母)
a、降低溫度 b、補充H2 c、移去甲醇 d、加入催化劑
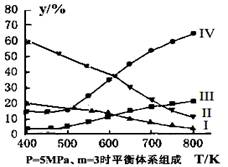
(3)在密閉容器中,對于反應II中,研究員以生產乙醇為研究對象,在5MPa、m= n(H2)/n(CO2)=3時,測得不同溫度下平衡體系中各種物質的體積分數(y%)如圖所示,則表示CH3CH2OH體積分數曲線的是 ;表示CO2的體積分數曲線的是 。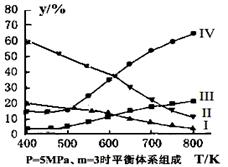
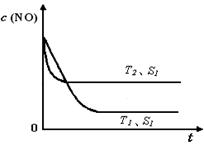
(4)當質量一定時,增大固體催化劑的表面積可提高化學反應速率。上圖是反應:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線,若催化劑的表面積S1>S2 ,在上圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。
2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線,若催化劑的表面積S1>S2 ,在上圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。
(11分)以CO2為碳源制取低碳有機物成為國際研究焦點,下面為CO2加氫制取低碳醇的熱力學數據:
反應I:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g)
△H = —49.0 kJ·mol-1
反應II:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
△H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g)
△H = —173.6 kJ·mol-1
(1)寫出由CH3CH2OH +_____ 2CH3OH的熱化學方程式為:__________________。
2CH3OH的熱化學方程式為:__________________。
(2)在一定條件下,對于反應I:在體積恒定的密閉容器中,達到平衡的標志是__ (填字母)
a.CO2和CH3OH 濃度相等 b.H2O的百分含量保持不變
c.H2的平均反應速率為0 d.v正(CO2)=3v逆(H2)
e.混合氣體的密度不再發生改變
f. 混合氣體的平均相對分子質量不再發生改變
如果平衡常數K值變大,該反應 (填字母)
a.一定向正反應方向移動 b.在平衡移動時正反應速率先增大后減小
c.一定向逆反應方向移動 d.在平衡移動時逆反應速率先減小后增大
其他條件恒定,如果想提高CO2的反應速率,可以采取的反應條件是 (填字母) ,
達到平衡后,想提高H2轉化率的是_______________(填字母)
a、降低溫度 b、補充H2 c、移去甲醇 d、加入催化劑
(3)在密閉容器中,對于反應II中,研究員以生產乙醇為研究對象,在5MPa、m= n(H2)/n(CO2)=3時,測得不同溫度下平衡體系中各種物質的體積分數(y%)如圖所示,則表示CH3CH2OH體積分數曲線的是 ;表示CO2的體積分數曲線的是 。
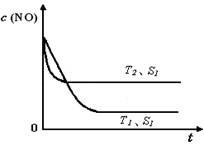
(4)當質量一定時,增大固體催化劑的表面積可提高化學反應速率。上圖是反應:2NO(g)
+ 2CO(g)
 2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線, 若催化劑的表面積S1>S2 ,在上圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。
2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線, 若催化劑的表面積S1>S2 ,在上圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。
 CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1 CH3CH2OH(g)+3H2O(g) △H =" —173.6" kJ·mol-1
CH3CH2OH(g)+3H2O(g) △H =" —173.6" kJ·mol-1 2CH3OH的熱化學方程式為:__________________。
2CH3OH的熱化學方程式為:__________________。

 2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線,若催化劑的表面積S1>S2 ,在上圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。
2CO2(g)+ N2(g) 中NO的濃度隨溫度(T)、催化劑表面積(S)和時間(t)的變化曲線,若催化劑的表面積S1>S2 ,在上圖中畫出NO的濃度在T1、S2 條件下達到平衡過程中的變化曲線,并注明條件。湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com