
題目列表(包括答案和解析)
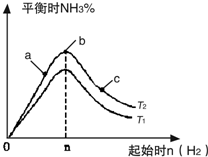 利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:
利用N2和H2可以實現NH3的工業合成,而氨又可以進一步制備硝酸,在工業上一般可進行連續生產.請回答下列問題:| n |
| 3 |
| n |
| 3 |
一定條件下,在一定體積的恒容密閉容器中,CO2與NH3在一定條件下反應生成尿素
CO2(g)+2NH3(g)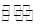 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
根據題意完成下列各題;
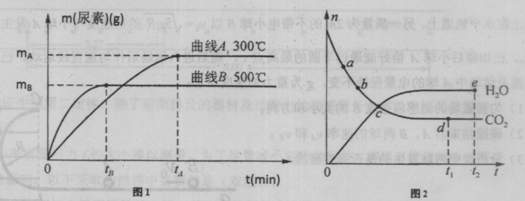
(1)500℃,用尿素表示該反應的反應速率,v(尿素)= mol/min.
(2)該反應的正反應△H 0(填“>”或“<”)。
(3)上圖2表示某溫度時一些反應物與產物物質的量(n)隨時間(t)變化的關系。
①對于該反應達到平衡狀態的判斷,下列說法正確的是 。
A.混合氣體的密度不再發生改變 B.圖2中C點時,該反應達到了平衡狀態
C.混合氣體的壓強不再發生改變 D.當消耗了2n mol NH3時,同時生成了n molH2O
②反應速率v(CO2):圖中點a b(填“>”、“<”或“=”)。
(4)用該原理生產尿素,工業上一般在220大氣壓下進行。其它條件不變,與常壓相比,220大氣壓時NH3的轉化率 (填增大、減小或不變。)反應的平衡常數K (填增大、減小或不變)。
(14分)鋇(Ba)和鍶(Sr)及其化合物在工業上有著廣泛的應用,它們在地殼中常以硫酸鹽的形式存在,BaSO4和SrSO4都是難溶性鹽。工業上提取鋇和鍶時首先將BaSO4和SrSO4轉化成難溶弱酸鹽。
已知:SrSO4(s)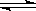 Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
SrSO3(s) Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
(1)將SrSO4轉化成SrCO3的離子方程式為 ,該反應的平衡常數表達式為 ;該反應能發生的原因是 。(用沉淀溶解再平衡的有關理論解釋)
(2)對于上述反應,實驗證明增大CO2-3的濃度或降低溫度都有利于提高SrSO4的轉化率。判斷在下列兩種情況下,平衡常數K的變化情況(填“增大”、“減小”或“不變”):
①升高溫度,平衡常數K將 ;
②增大CO2-3的濃度,平衡常數K將 。
(3)已知,SrSO4和SrCO3在酸中的溶解性與BaSO4和BaCO3類似,設計實驗證明上述過程中SrSO4是否完全轉化成SrCO3。
實驗所用試劑為 ;實驗現象及其相應結論 。
(4)BaCl2溶液和Ba(NO3)2溶液是實驗中檢驗SO2-4的常用試劑。某化學研究性學習小組檢驗某溶液中存在SO2-4時,首先加入Ba(NO3)2溶液,產生白色沉淀,然后加入過量稀硝酸,白色沉淀不溶解,由此得出結論:溶液中一定含有SO2-4。
你認為該推理是否嚴密?試說明理由。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com