
題目列表(包括答案和解析)
 2NH3是工業上合成氨的重要反應.
2NH3是工業上合成氨的重要反應.
 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol| 16 |
| a2 |
| 16 |
| a2 |

| 16 |
| a2 |
| 16 |
| a2 |
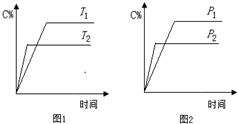 可逆反應A+a BC+2D(a為化學計量數),已知B、C、D為氣態物質.反應過程中,當其他條件不變時,C的百分含量(C%)與溫度(T)和壓強(p)的關系如圖所示.下列說法不正確的是( )
可逆反應A+a BC+2D(a為化學計量數),已知B、C、D為氣態物質.反應過程中,當其他條件不變時,C的百分含量(C%)與溫度(T)和壓強(p)的關系如圖所示.下列說法不正確的是( )| A、T2>T1,p2>p1 | B、該反應為放熱反應 | C、若a=2,則A為固態或液態物質 | D、增加B的物質的量,該反應的△H增大 |
可逆反應N2+3H2![]() 2NH3是工業上合成氨的重要反應。
2NH3是工業上合成氨的重要反應。

(1)根據圖1請寫出合成氨的熱化學方程式 (熱量用E1、E2或E3表示)
(2)圖1中虛線部分是通過改變化學反應中的 條件,請解釋原因
。
(3)當反應達到平衡位置時不斷改變條件(不改變N2、H2和NH3的量),圖2表示反應速率與反應過程的關系,其中表示平衡混合物中NH3的含量最高的一段時間是
(4)在一定溫度下,若將4a mol H2和2amol N2放入2L的密閉容器中,充分反應后測得N2的轉化率為50%,則該反應的平衡常數為 。若此時再向該容器中投入a mol H2、amol N2和2amol NH3,判斷平衡移動的方向是 (“正向移動”“ 逆向移動”或“不移動”)
(5)將上述實驗中產生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀較完全(即Fe3+濃度降至原來的千分之一),則溶液的pH為 (已知常溫下,Fe(OH)3的溶度積常數Ksp=4×10-38)
可逆反應N2+3H2 2NH3是工業上合成氨的重要反應。
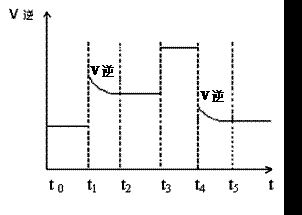
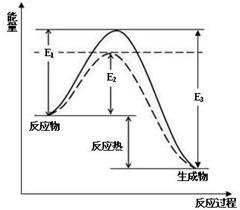
圖1 (圖中表示生成1mol物質時的能量) 圖2
(1)根據圖1請寫出合成氨的熱化學方程式 (熱量用E1、E2或E3表示)
(2) 圖1中虛線部分是通過改變化學反應中的 條件,請解釋原因
(3)當反應達到平衡位置時不斷改變條件(不改變N2、H2和NH3的量),圖2表示反應速率與反應過程的關系,其中表示平衡混合物中NH3的含量最高的一段時間是
(4)在一定溫度下,若將4a mol H2和2amol N2放入2L的密閉容器中,充分反應后測得N2的轉化率為50%,則該反應的平衡常數為 。若此時再向該容器中投入a mol H2、amol N2和2amol NH3,判斷平衡移動的方向是 (“正向移動”“ 逆向移動”或“不移動”)
(5)將上述實驗中產生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀較完全(即Fe3+濃度降至原來的千分之一),則溶液的pH為 (已知常溫下,Fe(OH)3的溶度積常數Ksp=4×10-38)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com