
題目列表(包括答案和解析)
(12分)工業上一般可采用如下反應來合成甲醇:
CO(g)+2H2(g) CH3OH(g)
ΔH =-a
kJ·mol-1
CH3OH(g)
ΔH =-a
kJ·mol-1

(1)上圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。
① a __0(填“>” “<” “=”)。
② 下列說法正確的是_ _(填序號)。
a.1 mol CO(g) 和2 mol H2(g) 所具有的能量小于1 mol CH3OH(g) 所具有的能量
b.將1 mol CO(g) 和2 mol H2(g) 置于一密閉容器中充分反應后放出a KJ的熱量
c.升高溫度,平衡向逆反應移動,上述熱化學方程式中的a值將減小
d.如將一定量CO(g) 和H2(g) 置于某密閉容器中充分反應后放熱a KJ,則此過程中有1 mol CO(g) 被還原
(2)在一定條件下,科學家利用從煙道氣中分離出CO2與太陽能電池電解水產生的H2合成甲醇,其過程如下圖所示:

① 該合成路線對于環境保護的價值在于_ _。
② 15%~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱堿性,上述合成線路中用作CO2
吸收劑。用離子方程式表示乙醇胺水溶液呈弱堿性的原因:
。
(3)甲醇燃料電池的工作原理如下左圖所示。該電池工作時,c口通入的物質發生的電極
反應式為:_ _。

(4)以上述電池做電源,用上右圖所示裝置,在實驗室中模擬鋁制品表面“鈍化”處理的過程中,發現溶液逐漸變渾濁,原因是(用相關的電極反應式和離子方程式表示):
_ 。
(8分)沼氣(主要成分是甲烷)是一種廉價的能源,把農村中大量存在的農作物秸稈、雜草、人畜糞便等在沼氣池中發酵,便可產生沼氣,沼氣完全燃燒可以用來點燈、做飯,還可以設計成燃料電池。
![]() (1)利用沼氣設計成燃料電池可實現如下能量轉化:(在框內填寫能量的形式)
(1)利用沼氣設計成燃料電池可實現如下能量轉化:(在框內填寫能量的形式)
(2)在101kPa時,16gCH4燃燒生成CO2和液態H2O,放出890kJ的熱量,寫出甲烷燃燒的熱化學方程式為______________ _______________。
(3)120℃,取CH4和過量O2的混合氣體共0.4mol,點燃使其充分反應并恢復到原狀態,將燃燒后的氣體通過過量的堿石灰(NaOH和CaO的固體混合物)充分吸收,堿石灰增重8g。
計算:①原混合氣體中CH4和O2的體積比是
②堿石灰吸收后剩余氣體在標準狀況下的體積為 。
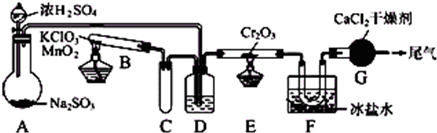
安徽省從2013年12月1日零時起,車用汽油升級為“國Ⅳ”標準,對二氧化硫的排放有了大大的改善。已知SO2可以用Fe( NO3)3溶液吸收, 0.1mol/L的Fe(NO3)3溶液的pH=2。某學習小組據此展開如下相關探究:
【探究I】銅與濃硫酸的反應探究:
(l)取12.8g銅片于三頸燒瓶中,通N2一段時間后再加入20 mL 18 mol?L-1的濃硫酸,加熱。裝置A中有白霧(硫酸酸霧)生成,裝置B中產生白色沉淀,充分反應后,燒瓶中仍有銅片剩余。
①該小組同學認為燒瓶中除有銅片剩余外還應有較多的硫酸剩余,其原因是: ___________________ 。
②該小組同學欲通過測定產生氣體的量來求余酸的物質的量,設計了多種實驗方案。下列方案不可行的是______ 。
A.將產生的氣體緩緩通過預先稱量的盛有堿石灰的干燥管,結束反應后再次稱重
B.將產生的氣體緩緩通入足量硫酸酸化的高錳酸鉀溶液后,再加入足量的BaCl2溶液,測量所得沉淀的質量
C.用排飽和NaHSO3溶液的方法測定其產生氣體的體積(折算成標準狀況)
【探究II】裝置B中產生沉淀的原因探究:
(2)加入濃硫酸之前先通N2一段時間,其目的是____ 。
(3)經過討論,該小組對裝置B中產生沉淀的原因,提出下列猜想(不考慮各因素的疊加):
猜想1: 裝置A中的白霧進入B參與反應
猜想2:SO2被Fe3+氧化為SO42-
猜想3: 。
(4)甲同學認為只要在裝置A、B間增加洗氣瓶C,就可以排除裝置A中白霧影響,則C中盛放的試劑是 。
(5)乙同學取出少量裝置B中清液,加入幾滴酸性高錳酸鉀,發現紫紅色褪去,據此認為猜想2成立。你是否同意其結論?并說明理由: 。
【思考與交流】
(6)實驗結束后,若使燒瓶中銅片繼續溶解,下列方案(必要時可加熱)可行的是 。
A.打開彈簧夾,通入O2 B.由分液漏斗加入H2O2溶液
C.由分液漏斗加入NaNO3溶液 D.由分液漏斗加入Na2SO4溶液
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com