過碳酸鈉俗稱固體雙氧水,被大量應用于洗滌、印染、紡織、造紙、醫藥衛生等領域中,它的制備原理和路線如下:2Na
2CO
3+3H
2O
2=2Na
2CO
3?3H
2O
2△H<0
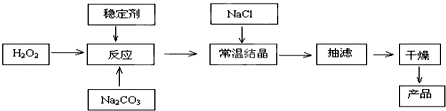
回答下列問題:
(1)與過碳酸鈉的用途相關的化學性質是
強氧化性
強氧化性
.
(2)下列物質可使過碳酸鈉較快失效的是
abc
abc
.
a.MnO
2 b.H
2S c.稀硫酸 d.NaHCO
3(3)加入NaCl的實驗操作名稱是
鹽析
鹽析
;作用是
降低2Na2CO3?3H2O2溶解度,析出更多晶體
降低2Na2CO3?3H2O2溶解度,析出更多晶體
.
(4)工業純堿中含有Fe
3+等雜質,加入穩定劑的作用是與Fe
3+生成穩定的配合物,Fe
3+對反應的不良影響是
催化雙氧水的分解
催化雙氧水的分解
.
(5)反應的最佳溫度控制在15℃~20℃,溫度偏高時造成產率低可能是
溫度高時雙氧水易分解
溫度高時雙氧水易分解
,溫度偏低時造成產率低的可能是
溫度低時反應緩慢
溫度低時反應緩慢
.
(6)以上抽濾過程中遺漏了一步操作,造成所得產品純度偏低,該步操作的名稱是
洗滌
洗滌
;進行該操作的方法是:
向置于過濾器上的沉淀加蒸餾水至剛好淹沒沉淀,靜置,待水自然流出后,再重復操作兩到三次
向置于過濾器上的沉淀加蒸餾水至剛好淹沒沉淀,靜置,待水自然流出后,再重復操作兩到三次
.
(7)準確稱取0.2000g 過碳酸鈉樣品于250mL 錐形瓶中,加50mL 蒸餾水溶解,再加50mL 2.0mol?L
-1 H
2SO
4,用2.000×10
-2 mol?L
-1 KMnO
4 標準溶液滴定至終點時消耗30.00mL,則產品中H
2O
2的質量分數為
25.50%
25.50%
.


 已知Cr(OH)3在堿性較強的溶液中將生成[Cr(OH)4]-,鉻的化合物有毒,由于+6價鉻的強氧化性,其毒性是+3價鉻毒性的100倍.因此,必須對含鉻的廢水進行處理,可采用以下兩種方法:
已知Cr(OH)3在堿性較強的溶液中將生成[Cr(OH)4]-,鉻的化合物有毒,由于+6價鉻的強氧化性,其毒性是+3價鉻毒性的100倍.因此,必須對含鉻的廢水進行處理,可采用以下兩種方法:
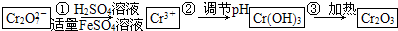
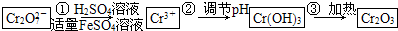
 與FeSO4溶液在酸性條件下反應的離子方程式______.
與FeSO4溶液在酸性條件下反應的離子方程式______.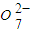 發生反應,生成的Fe3+和Cr3+在陰極區與OH-結合生成Fe(OH)3和Cr(OH)3沉淀除去.
發生反應,生成的Fe3+和Cr3+在陰極區與OH-結合生成Fe(OH)3和Cr(OH)3沉淀除去.

