
題目列表(包括答案和解析)
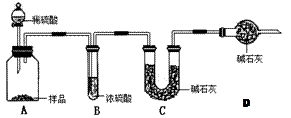
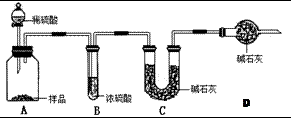 工業上制純堿的方法是向飽和食鹽水中通入氨氣和二氧化碳,獲得碳酸氫鈉晶體,再將所得碳酸氫鈉晶體加熱分解后即可得到純堿(純堿樣品中Na2CO3的質量分數為92%~96%)。涉及到的化學方程式有:
工業上制純堿的方法是向飽和食鹽水中通入氨氣和二氧化碳,獲得碳酸氫鈉晶體,再將所得碳酸氫鈉晶體加熱分解后即可得到純堿(純堿樣品中Na2CO3的質量分數為92%~96%)。涉及到的化學方程式有:
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(飽和)→ NaHCO3↓+NH4Cl,![]() 。請回答:
。請回答:
(1)工業制得的純堿中常常含有少量的氯化鈉雜質,其主要原因是 。
(2)現有甲、乙、丙三個學生,欲測定某工業純堿樣品中Na2CO3的質量分數,分別設計如下方案,請你幫助他們完成如下實驗。
甲:用 (填實驗儀器)稱取10.0g樣品,利用上圖所示裝置,測出反應后裝置C中堿石灰增重3.52g。裝置D中堿石灰的作用是 。
乙:準確稱取10.00g樣品后,用 (填實驗儀器)配成1000mL溶液,用
式滴定管量取25.00mL放入錐形瓶中,加入2滴酚酞作指示劑,用0.15mol·L-1的標準鹽酸溶液滴定至終點(有關反應為Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行實驗后,消耗鹽酸體積的平均值為15.00mL。
丙:準確稱取10.00g樣品后,向其中加入過量的鹽酸,充分反應直至樣品中無氣泡冒出,蒸干混合溶液將所得到固體物質于干燥器中冷卻至室溫后稱量。反復加熱、冷卻、稱量,直至所稱量的固體質量幾乎不變為止,此時所得固體的質量為10.99g。請分析、計算后填表:
| 分析與計算 分組 | 計算樣品中碳酸鈉的質量分數 | 實驗結果的評價 | 實驗失敗的主要原因及對結果的影響 |
| 甲 |
| 失 敗 | |
| 乙 |
|
| |
| 丙 |
|
|
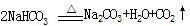 。請回答:
。請回答:| 分析與計算 分組 | 計算樣品中碳酸鈉的質量分數 | 實驗結果的評價 | 實驗失敗的主要原因及對結果的影響 |
| 甲 | | 失 敗 | |
| 乙 | |  成 功 成 功 | |
| 丙 | |  成 功 成 功 | |

| ||
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com