
題目列表(包括答案和解析)
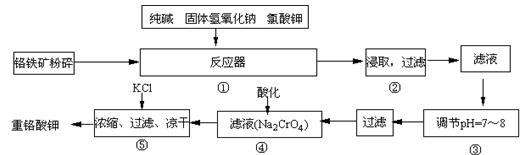
重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成份為FeO·Cr2O3)為原料生產,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的
主要工藝如下,涉及的主要反應是:
6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3 +7KCl+12H2O,
12Na2CrO4+3Fe2O3 +7KCl+12H2O,
試回答下列問題:
(1)在反應器①中,有Na2CrO4生成,同時Fe2O3轉變為NaFeO2,雜質SiO2、Al2O3與純堿反應轉變為可溶性鹽,寫出氧化鋁與碳酸鈉反應的化學方程式: 。
(2)操作③的目的是什么,用簡要的文字說明: 。
(3)操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式: 。
(4)稱取重鉻酸鉀試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL
2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判斷達到滴定終點的依據是: ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品中重鉻酸鉀的純度(設整個過程中其它雜質不參與反應) 。
(15分)重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成份為FeO·Cr2O3)為原料生產,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如下,涉及的主要反應是:6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O,
試回答下列問題:
(1)在反應器①中,有Na2CrO4生成,同時Fe2O3轉變為NaFeO2,雜質SiO2、Al2O3與純堿反應轉變為可溶性鹽,寫出氧化鋁與碳酸鈉反應的化學方程式:
。
(2)操作③的目的是什么,用簡要的文字說明:
。
(3)操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式:
。
(4)稱取重鉻酸鉀試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定。
(I2+2S2O32-=2I-+S4O62-)
①判斷達到滴定終點的依據是: ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品中重鉻酸鉀的純度(設整個過程中其它雜質不參與反應) %(保留小數點后兩位)。
重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成份為FeO·Cr2O3)為原料生產,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如下,涉及的主要反應是:6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3+7KCl+12H2O,
試回答下列問題:
⑴在反應器①中,有Na2CrO4生成,同時Fe2O3轉變為NaFeO2,雜質SiO2、Al2O3與純堿反應轉變為可溶性鹽,寫出氧化鋁與碳酸鈉反應的化學方程式:
。
⑵NaFeO2能強烈水解,在操作②生成沉淀而除去,寫出該反應的化學方程式:
。
⑶操作③的目的是什么,用簡要的文字說明: 。
⑷操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式:
。
⑸稱取重鉻酸鉀試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①判斷達到滴定終點的依據是: ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品的中重鉻酸鉀的純度(設整個過程中其它雜質不參與反應) 。
重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成份為FeO·Cr2O3)為原料生產,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的
主要工藝如下,涉及的主要反應是:
6FeO·Cr2O3+24NaOH+7KClO312Na2CrO4+3Fe2O3 +7KCl+12H2O,
試回答下列問題:
(1)在反應器①中,有Na2CrO4生成,同時Fe2O3轉變為NaFeO2,雜質SiO2、Al2O3與純堿反應轉變為可溶性鹽,寫出氧化鋁與碳酸鈉反應的化學方程式: 。
(2)操作③的目的是什么,用簡要的文字說明: 。
(3)操作④中,酸化時,CrO42-轉化為Cr2O72-,寫出平衡轉化的離子方程式: 。
(4)稱取重鉻酸鉀試樣2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL
2mol/LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min,然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定(I2+2S2O32-=2I-+S4O62-)
①判斷達到滴定終點的依據是: ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品中重鉻酸鉀的純度(設整個過程中其它雜質不參與反應) 。
重鉻酸鉀是工業生產和實驗室的重要氧化劑,工業上常用鉻鐵礦(主要成分為FeO·Cr2O3,雜質為SiO2、Al2O3)為原料產它,實驗室模擬工業法用鉻鐵礦制K2Cr2O7的主要工藝如下圖。涉及的主要反應是6FeO·Cr2O3+24NaOH+7KClO3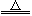 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
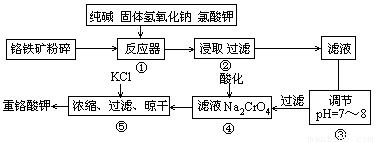
(1)堿浸前將銘鐵礦粉碎的作用是
(2)步驟③調節pH后過濾得到的濾渣是 。
(3)操作④中,酸化時,CrO2- 4轉化為Cr2O2- 7,寫出平衡轉化的離子方程式
;
(4)用簡要的文字說明操作⑤加入KCl的原因 。
(5)稱取重鉻酸鉀試樣2.500g配成250mL溶液,取出25mL與碘量瓶中,加入10mL2mol/ LH2SO4和足量碘化鉀(鉻的還原產物為Cr3+),放于暗處5min。然后加入100mL水,加入3mL淀粉指示劑,用0.1200mol/LNa2S2O3標準溶液滴定(I2+2S2O2- 3=2I- +S4O2- 6)
①判斷達到滴定終點的依據是 ;
②若實驗中共用去Na2S2O3標準溶液40.00mL,則所得產品中重鉻酸鉀的純度為(設整個過程中其它雜質不參加反應) (保留2位有效數字)。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com