
題目列表(包括答案和解析)
硫化堿法是工業上制備Na2S2O3的方法之一,反應原理為:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(該反應△H>0)。某研究小組在實驗室用硫化堿法制備Na2S2O3·5H2O流程如下。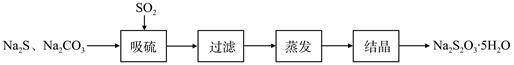
(1)吸硫裝置如圖所示。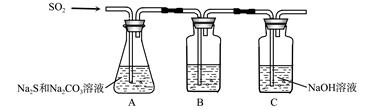
①裝置B的作用是檢驗裝置A中SO2的吸收效率,B中試劑是 ,表明SO2吸收效率低的實驗現象是B中溶液 。
②為了使SO2盡可能吸收完全,在不改變A中溶液濃度、體積的條件下,除了及時攪拌反應物外,還可采取的合理措施是 、 。(寫出兩條)
(2)假設本實驗所用的Na2CO3含少量NaCl、NaOH,設計實驗方案進行檢驗。(室溫時CaCO3飽和溶液的pH=10.2)
限選試劑及儀器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸餾水、pH計、燒杯、試管、滴管
| 序號 | 實驗操作 | 預期現象 | 結論 |
| ① | 取少量樣品于試管中,加入適量蒸餾水,充分振蕩溶解,___________________。 | _______________ | 樣品含NaCl |
| ② | 另取少量樣品于燒杯中,加入適量蒸餾水,充分攪拌溶解,___________________。 | _______________ | 樣品含NaOH |
| 序號 | 實驗操作 | 預期現象 | 結論 |
| ① | 取少量樣品于試管中,加入適量蒸餾水,充分振蕩溶解,___________________。 | _______________ | 樣品含NaCl |
| ② | 另取少量樣品于燒杯中,加入適量蒸餾水,充分攪拌溶解,___________________。 | _______________ | 樣品含NaOH |
二氧化氯(ClO2)是國內外公認的高效、廣譜、快速、安全無毒的殺菌消毒劑,被稱為“第4代消毒劑”。工業上可采用氯酸鈉(NaClO3)或亞氯酸鈉(NaClO2)為原料制備ClO2。
(1)亞氯酸鈉也是一種性能優良的漂白劑,但在強酸性溶液中會發生歧化反應,產生ClO2氣體,離子方程式為???????????????????????????????????????????????? 。向亞氯酸鈉溶液中加入鹽酸,反應劇烈。若將鹽酸改為相同pH的硫酸,開始時反應緩慢,稍后一段時間產生氣體速率迅速加快。產生氣體速率迅速加快的原因是????????????????????????????????????? 。
(2)化學法可采用鹽酸或雙氧水還原氯酸鈉制備ClO2。用H2O2作還原劑制備的ClO2更適合用于飲用水的消毒,其主要原因是?????????????????????????????????? 。
(3)電解法是目前研究最為熱門的生產ClO2的方法之一。如圖所示為直接電解氯酸鈉、自動催化循環制備高純ClO2的實驗。

①電源負極為?????? 極(填A或B):
②寫出陰極室發生反應依次為:??????????????????????? 、
??????????????????????????? ;
③控制電解液H+不低于5mol/L,可有效防止因H+濃度降低而導致的ClO2﹣歧化反應。若兩極共收集到氣體22.4L(體積已折算為標準狀況,忽略電解液體積的變化和ClO2氣體溶解的部分),此時陽極室與陰極室c(H+)之差為????????????? 。
二氧化氯(ClO2)是國內外公認的高效、廣譜、快速、安全無毒的殺菌消毒劑,被稱為“第4代消毒劑”。工業上可采用氯酸鈉(NaClO3)或亞氯酸鈉(NaClO2)為原料制備ClO2。
(1)亞氯酸鈉也是一種性能優良的漂白劑,但在強酸性溶液中會發生歧化反應,產生ClO2氣體,離子方程式為 。向亞氯酸鈉溶液中加入鹽酸,反應劇烈。若將鹽酸改為相同pH的硫酸,開始時反應緩慢,稍后一段時間產生氣體速率迅速加快。產生氣體速率迅速加快的原因是 。
(2)化學法可采用鹽酸或雙氧水還原氯酸鈉制備ClO2。用H2O2作還原劑制備的ClO2更適合用于飲用水的消毒,其主要原因是 。
(3)電解法是目前研究最為熱門的生產ClO2的方法之一。如圖所示為直接電解氯酸鈉、自動催化循環制備高純ClO2的實驗。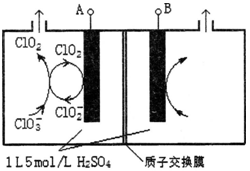
①電源負極為 極(填A或B):
②寫出陰極室發生反應依次為: 、
;
③控制電解液H+不低于5mol/L,可有效防止因H+濃度降低而導致的ClO2﹣歧化反應。若兩極共收集到氣體22.4L(體積已折算為標準狀況,忽略電解液體積的變化和ClO2氣體溶解的部分),此時陽極室與陰極室c(H+)之差為 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com