
題目列表(包括答案和解析)
(12分)化學反應速率與生產、生活密切相關。
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,他在200mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL)(標準狀況) | 50 | 120 | 232 | 288 | 310 |
① 哪一時間段(指0~1、1~2、2~3、3~4、4~5 min)反應速率最小 ,
原因是 。
② 哪一時間段的反應速率最大 ,原因是 。
③ 求3~4分鐘時間段以鹽酸的濃度變化來表示的該反應速率 。
(設溶液體積不變)
④ 如果反應太激烈,為了減緩反應速率而又不減少產生氫氣的量,他可采取的措施是 :
A.加蒸餾水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
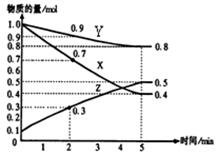
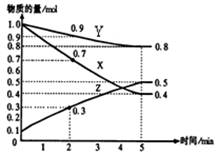
(2)已知某溫度時,在2L容器中X、Y、Z三種物質隨時間的變化關系曲線如圖所示。該反應的化學方程式為: 。
(12分)化學反應速率與生產、生活密切相關。
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,他在200mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
| 時間(min) | 1 | 2 | 3 | 4 | 5 |
| 氫氣體積(mL)(標準狀況) | 50 | 120 | 232 | 288 | 310 |
化學反應原理在工業生產中具有十分重要的意義。
(1)合成氨用的氫氣有多種制取方法:請你寫出用C制備水煤氣的化學反應方程式 。還可以由天然氣或重油制取氫氣:CH4+H2O(g) 高溫催化劑CO+3H2;比較以上兩種方法轉移6mol電子時,C和CH4的質量之比是 。
(2)工業生產可以用NH3(g)與CO2(g)經過兩步反應生成尿素,兩步反應的能量變化示意圖如下:
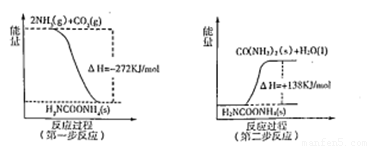
則NH3(g)與CO2(g)反應生成尿素的熱化學方程式為 。
(3)已知反應Fe(s)+CO2(g)=FeO(s)+CO(g) △H=akJ/mol。測得在不同溫度下,該反應的平衡常數K隨溫度的變化如下:
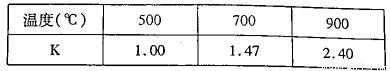
①該反應的化學平衡常數表達式K= ,a 0(填“>”、“<”或“:”)。在500℃2L密閉容器中進行反應,Fe和CO2的起始量均為4 mol,則5min后達到平街時CO2的轉化率為 ,生成CO的平均速率v(CO)為 。
②700℃反應達到平衡后,要使該平衡向右移動,其他條件不變時,可以采取的措施有 (填字母)。
A.縮小反應器容積 B.增加Fe的物質的量
C.升高溫度到900℃ D.使用合適的催化劑
(12分)化學反應速率與生產、生活密切相關。
(1)某學生為了探究鋅與鹽酸反應過程中的速率變化,他在200mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):
|
時間(min) |
1 |
2 |
3 |
4 |
5 |
|
氫氣體積(mL)(標準狀況) |
50 |
120 |
232 |
288 |
310 |
① 哪一時間段(指0~1、1~2、2~3、3~4、4~5 min)反應速率最小 ,
原因是 。
② 哪一時間段的反應速率最大 ,原因是 。
③ 求3~4分鐘時間段以鹽酸的濃度變化來表示的該反應速率 。
(設溶液體積不變)
④ 如果反應太激烈,為了減緩反應速率而又不減少產生氫氣的量,他可采取的措施是 :
A.加蒸餾水 B.加Na2CO3溶液 C.加NaCl溶液 D.加NaNO3溶液
(2)已知某溫度時,在2L容器中X、Y、Z三種物質隨時間的變化關系曲線如圖所示。該反應的化學方程式為: 。
化學反應原理在工業生產中具有十分重要的意義。
(1)合成氨用的氫氣有多種制取方法:請你寫出用C制備水煤氣的化學反應方程式 。還可以由天然氣或重油制取氫氣:CH4+H2O(g) 高溫催化劑CO+3H2;比較以上兩種方法轉移6mol電子時,C和CH4的質量之比是 。
(2)工業生產可以用NH3(g)與CO2(g)經過兩步反應生成尿素,兩步反應的能量變化示意圖如下: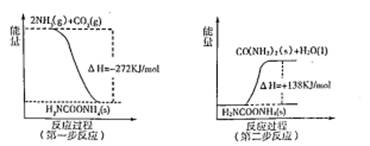
則NH3(g)與CO2(g)反應生成尿素的熱化學方程式為 。
(3)已知反應Fe(s)+CO2(g)=FeO(s)+CO(g) △H=akJ/mol。測得在不同溫度下,該反應的平衡常數K隨溫度的變化如下:
①該反應的化學平衡常數表達式K= ,a 0(填“>”、“<”或“:”)。在500℃2L密閉容器中進行反應,Fe和CO2的起始量均為4 mol,則5min后達到平街時CO2的轉化率為 ,生成CO的平均速率v(CO)為 。
②700℃反應達到平衡后,要使該平衡向右移動,其他條件不變時,可以采取的措施有 (填字母)。
| A.縮小反應器容積 | B.增加Fe的物質的量 |
| C.升高溫度到900℃ | D.使用合適的催化劑 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com