隨著化石能源的減少,新能源的開發利用日益迫切.
(1)Bunsen熱化學循環制氫工藝由下列三個反應組成:
SO
2(g)+I
2(g)+2H
2O(g)=2HI (g)+H
2SO
4(l)△H=a kJ?mol
-12H
2SO
4(l)=2H
2O(g)+2SO
2(g)+O
2(g)△H=b kJ?mol
-12HI(g)=H
2(g)+I
2(g)△H=c kJ?mol
-1則:2H
2O(g)=2H
2(g)+O
2(g)△H=
kJ?mol
-1(2)甲醇制氫有以下三個反應:
CH
3OH(g)=CO(g)+2H
2(g)△H=+90.8kJ?mol
-1 Ⅰ
CO(g)+H
2O(g)=CO
2(g)+H
2(g)△H=-43.5kJ?mol
-1 Ⅱ
CH
3OH(g)+
O
2(g)=CO
2(g)+2H
2(g)△H=-192.0kJ?mol
-1 Ⅲ
①當CH
3OH(g)、O
2(g)、H
2O(g)總進料量為1mol時,且n(CH
3OH):n(H
2O):n(O
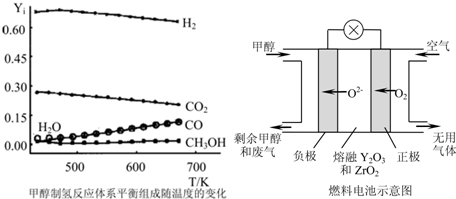
2)=0.57:0.28:0.15,在0.1MPa、473~673K溫度范圍內,各組分的平衡組成隨溫度變化的關系曲線見圖.(圖中Y
i表示各氣體的體積分數,氧氣的平衡濃度接近0,圖中未標出).下列說法正確的是
.
A.在0.1MPa、473~673K溫度范圍內,甲醇有很高的轉化率
B.溫度升高有利于氫氣的制備
C.尋找在較低溫度下的催化劑在本制氫工藝中至關重要
②已知反應Ⅱ在T
1℃時K=1,向恒容的密閉容器中同時充入1.0mol CO、3.0molH
2O,達到平衡時CO的轉化率為
.在反應達到平衡后再向其中加入1.0mol CO、1.0mol H
2O、1.0mol CO
2和1.0mol H
2,此時該反應的v
正
v
逆(填“>”、“<”或“=”).
(3)一種以甲醇作燃料的電池示意圖見圖.寫出該電池放電時負極的電極反應式:
.
(4)LiBH
4有很高的燃燒熱,可做火箭的燃料,寫出其燃燒反應的化學方程式:
.


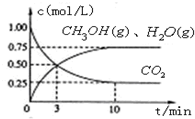
 A.在300℃,從反應開始到平衡,甲醇的平均反應速率v(CH3OH)=
A.在300℃,從反應開始到平衡,甲醇的平均反應速率v(CH3OH)=