
題目列表(包括答案和解析)
DME(二甲醚、CH3OCH3)是一種重要的清潔能源,可作為柴油的理想替代燃料和民用燃料,被譽為“二十一世紀的新能源”。另外,二甲醚還被廣泛用作致冷劑、氣霧劑以及有機化工中間體。
(1)工業上一步法制二甲醚的生產流程如下:
工業制備二甲醚(CH3OCH3)在催化反應室中(壓強2.0-10.0Mpa,溫度230-2800C)進行下列反應:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H = —90.7kJ·mol—1
CH3OH(g) △H = —90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1
CH3OCH3(g)+H2O(g)△H = —23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H = —41.2kJ·mol—1
CO2(g)+H2(g)△H = —41.2kJ·mol—1
①反應器中總反應式可表示為:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),則該反應的△H =
CH3OCH3(g)+CO2(g),則該反應的△H =
②下列有關反應Ⅲ的說法正確的是
A.在體積可變的密閉容器中,在反應Ⅲ達到平衡后,若加壓,則平衡不移動、混合氣體平均相對分子質量不變、混合氣體密度不變。
B.某溫度下,若向已達到平衡的的反應Ⅲ中加入等物質的量的CO和H2O,則平衡右移、平衡常數變大
C. 若830℃時反應③的K=1,則在催化反應室中反應Ⅲ的K>1.0
(2)CO2是大氣中含量最高的一種溫室氣體,控制和治理CO2是解決溫室效應的有效途徑。目前,由CO2來合成二甲醚已取得了較大的進展,其化學反應是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H>0。判斷該反應在一定條件下,體積恒定的密閉容器中是否達到化學平衡狀態的依據是 。A.容器中密度不變 B.單位時間內消耗2molCO2,同時消耗1mol二甲醚
CH3OCH3(g)+3H2O(g)△H>0。判斷該反應在一定條件下,體積恒定的密閉容器中是否達到化學平衡狀態的依據是 。A.容器中密度不變 B.單位時間內消耗2molCO2,同時消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器內壓強保持不變
(3)二甲醚也可以通過CH3OH分子間脫水制得
在 ,恒容密閉容器中建立上述平衡,體系中各組分濃度隨時間變化如圖所示。
,恒容密閉容器中建立上述平衡,體系中各組分濃度隨時間變化如圖所示。
①該條件下反應平衡常數表達式K=______根據圖中數據計算 時該反應的平衡常數為
時該反應的平衡常數為
②相同條件下,若改變起始濃度,某時刻各組分濃度依次為: 、
、 此時正、逆反應速率的大小:
此時正、逆反應速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)下圖為二甲醚燃料電池的工作原理示意圖。
請回答下列問題:
①A電極是 極。
②B電極上發生的電極反應式是 。
DME(二甲醚、CH3OCH3)是一種重要的清潔能源,可作為柴油的理想替代燃料和民用燃料,被譽為“二十一世紀的新能源”。另外,二甲醚還被廣泛用作致冷劑、氣霧劑以及有機化工中間體。
(1)工業上一步法制二甲醚的生產流程如下:
工業制備二甲醚(CH3OCH3)在催化反應室中(壓強2.0-10.0Mpa,溫度230-2800C)進行下列反應:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H =—90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) △H =—23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2kJ·mol—1
①反應器中總反應式可表示為:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),則該反應的△H=
②下列有關反應Ⅲ的說法正確的是
A.在體積可變的密閉容器中,在反應Ⅲ達到平衡后,若加壓,則平衡不移動、混合氣體平均相對分子質量不變、混合氣體密度不變。
B.某溫度下,若向已達到平衡的的反應Ⅲ中加入等物質的量的CO和H2O,則平衡右移、平衡常數變大
C. 若830℃時反應③的K=1,則在催化反應室中反應Ⅲ的K>1.0
(2)CO2是大氣中含量最高的一種溫室氣體,控制和治理CO2是解決溫室效應的有效途徑。目前,由CO2來合成二甲醚已取得了較大的進展,其化學反應是:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H>0。判斷該反應在一定條件下,體積恒定的密閉容器中是否達到化學平衡狀態的依據是 。A.容器中密度不變 B.單位時間內消耗2molCO2,同時消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器內壓強保持不變
(3) 二甲醚也可以通過CH3OH分子間脫水制得
在,恒容密閉容器中建立上述平衡,體系中各組分濃度隨時間變化如圖所示。
①該條件下反應平衡常數表達式K=______根據圖中數據計算時該反應的平衡常數為
②相同條件下,若改變起始濃度,某時刻各組分濃度依次為:
、
此時正、逆反應速率的大小:
_______
(填“>”、“<”、或“=”)。
(4)下圖為二甲醚燃料電池的工作原理示意圖。
請回答下列問題:
①A電極是 極。
②B電極上發生的電極反應式是 。
2013年霧霾天氣多次肆虐我國中東部地區。其中汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。
(1)汽車尾氣凈化的主要原理為:2NO(g)+2CO 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①對于氣相反應,用某組分(B)的平衡壓強(PB)代替物質的量濃度(CB)也可以表示平衡常數(記作KP),則該反應的KP=-???????????????? 。
②該反應在低溫下能自發進行,該反應的ΔH ????????? 0。(選填“>”、“<”)
③在某一絕熱、恒容的密閉容器中充入一定量的NO、CO發生上述反應,測得正反應的速率隨時間變化的曲線如圖所示(已知:t2 --tl=t3-t2)。

則下列說法不正確的是????????? 。(填編號)
A.反應在c點未達到平衡狀態
B.反應速率a點小于b點
C.反應物濃度a點大于b點
D.NO的轉化率:tl~t2>t2~t3
(2)煤的綜合利用、使用清潔能源等有利于減少環境污染。合成氨工業原料氣的來源之一水煤氣法,在催化劑存在條件下有下列反應:
①
②
③
①△H3和△H1、△H2的關系為△H3=???????????? 。
②在恒溫條件下,將l mol CO和1 mol H2O(g)充入某固定容積的反應容器,達到平衡時有50%的CO轉化為CO2。在tl時保持溫度不變,再充入1 mol H2O(g),請在圖中畫出tl時刻后H2的體積分數變化趨勢曲線。

③甲醇汽油可’以減少汽車尾氣對環境的污染。
某化工廠用水煤氣為原料合成甲醇,恒溫條件下,在體積可變的密閉容器中發生反應:CO(g)+2H2(g)  CH3OH(g)到達平衡時,測得CO、H2、CH3OH分別為1 mol、1 mol、1 mol,容器的體積為3L,現往容器中繼續通人3 mol CO,此時v(正)??????? ? v(逆)(選填‘‘>”、“<’’或“=”),判斷的理由??????? 。
CH3OH(g)到達平衡時,測得CO、H2、CH3OH分別為1 mol、1 mol、1 mol,容器的體積為3L,現往容器中繼續通人3 mol CO,此時v(正)??????? ? v(逆)(選填‘‘>”、“<’’或“=”),判斷的理由??????? 。
DME(二甲醚、CH3OCH3)是一種重要的清潔能源,可作為柴油的理想替代燃料和民用燃料,被譽為“二十一世紀的新能源”。另外,二甲醚還被廣泛用作致冷劑、氣霧劑以及有機化工中間體。
(1)工業上一步法制二甲醚的生產流程如下:
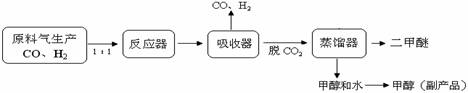
工業制備二甲醚(CH3OCH3)在催化反應室中(壓強2.0-10.0Mpa,溫度230-2800C)進行下列反應:
Ⅰ.CO(g)+2H2(g) CH3OH(g) △H =
—90.7kJ·mol—1
CH3OH(g) △H =
—90.7kJ·mol—1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g) △H =
—23.5kJ·mol—1
CH3OCH3(g)+H2O(g) △H =
—23.5kJ·mol—1
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g) △H = —41.2kJ·mol—1
CO2(g)+H2(g) △H = —41.2kJ·mol—1
①反應器中總反應式可表示為:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),則該反應的△H
=
CH3OCH3(g)+CO2(g),則該反應的△H
=
②下列有關反應Ⅲ的說法正確的是
A.在體積可變的密閉容器中,在反應Ⅲ達到平衡后,若加壓,則平衡不移動、混合氣體平均相對分子質量不變、混合氣體密度不變。
B.某溫度下,若向已達到平衡的的反應Ⅲ中加入等物質的量的CO和H2O,則平衡右移、平衡常數變大
C. 若830℃時反應③的K=1,則在催化反應室中反應Ⅲ的K>1.0
(2)CO2是大氣中含量最高的一種溫室氣體,控制和治理CO2是解決溫室效應的有效途徑。目前,由CO2來合成二甲醚已取得了較大的進展,其化學反應是:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H>0。判斷該反應在一定條件下,體積恒定的密閉容器中是否達到化學平衡狀態的依據是 。A.容器中密度不變
B.單位時間內消耗2molCO2,同時消耗1mol二甲醚
CH3OCH3(g)+3H2O(g) △H>0。判斷該反應在一定條件下,體積恒定的密閉容器中是否達到化學平衡狀態的依據是 。A.容器中密度不變
B.單位時間內消耗2molCO2,同時消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3 D.容器內壓強保持不變
(3) 二甲醚也可以通過CH3OH分子間脫水制得

在 ,恒容密閉容器中建立上述平衡,體系中各組分濃度隨時間變化如圖所示。
,恒容密閉容器中建立上述平衡,體系中各組分濃度隨時間變化如圖所示。

①該條件下反應平衡常數表達式K=______根據圖中數據計算 時該反應的平衡常數為
時該反應的平衡常數為
②相同條件下,若改變起始濃度,某時刻各組分濃度依次為:
 、
、 此時正、逆反應速率的大小:
此時正、逆反應速率的大小: _______
_______ (填“>”、“<”、或“=”)。
(填“>”、“<”、或“=”)。
(4)下圖為二甲醚燃料電池的工作原理示意圖。

請回答下列問題:
①A電極是 極。
②B電極上發生的電極反應式是 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com