
題目列表(包括答案和解析)
純堿在日常生活和工業生產中用途廣泛,需求量很大,因此純堿的制備一直是科學家工作的一個重要方面.19世紀歐洲有個呂布蘭制堿法,其主要反應原理是:
Na2SO4+2C這種方法的最大缺點是:①此反應是高溫固體反應,不能連續生產;②浪費原料,CO2不能回收利用;③污染環境,CaS沒有任何用處,只能拋至野外.由于這些缺點的存在和后來化學工業的發展,呂布蘭法被索爾維法代替.索爾維法的生產流程如下:
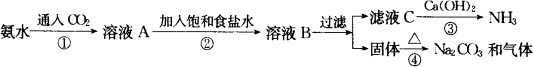
索爾維法能實現連續生產,但其食鹽利用率只有70%,且所得副產品CaCl2沒有用處,污染環境.
我國化學家侯德榜經過一年的努力,做了500多次循環實驗,終于設計出新的制堿工藝,于1943年11月在完成實驗室規模的流程實驗基礎上,在工廠順利試產,食鹽的利用率達96%以上,得到了純堿和氯化銨兩種重要產品.氯化銨主要用作氮肥.侯德榜制堿法的原理是:
①在30~50℃的飽和食鹽水中,先通入氨至飽和再通入二氧化碳得到碳酸氫鈉沉淀;
②過濾,將濾渣加熱而得到產品;
③濾液中加入細食鹽末,在10~15℃,使NH4Cl沉淀,過濾,濾液為飽和食鹽水.
據此回答下列問題:
(1)標出反應Na2SO4+2C![]() Na2S+2CO2↑的電子轉移方向和數目.
Na2S+2CO2↑的電子轉移方向和數目.
(2)寫出索爾維制堿法的各步反應的化學反應方程式:
①________;②________;
③________;④________.
(3)寫出侯德榜制堿法第①步反應的化學反應方程式________.
(4)在索爾維制堿法中________物體可循環利用.
(5)在侯德榜制堿法中________物體可循環利用.
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com