
題目列表(包括答案和解析)
(1)下列實驗操作或對實驗事實的描述不正確的有 (填序號)。
A.用托盤天平稱量17.55g氯化鈉晶體
B.碳酸鈉溶液保存在帶玻璃塞的試劑瓶
C.用干燥的pH試紙測定新制氯水的pH
D.使用容量瓶配制溶液時,俯視刻度線定容后濃度偏大
E.向飽和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3膠體
F.除去CO2氣體中混有的少量HCl,可以將氣體通入飽和碳酸氫鈉溶液
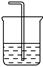
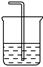
(2)下圖為中學化學實驗中常見的實驗裝置



A B C
實驗室常用裝置A制備下表中氣體,請將分液漏斗和圓底燒瓶中應裝的化學試劑填寫完整。
|
氣體 |
O2 |
Cl2 |
NH3 |
|
分液漏斗中試劑 |
|
|
濃氨水 |
|
圓底燒瓶中試劑 |
|
KMnO4 |
|
可用B裝置排液收集氣體,氣體應從該裝置________(填“左”“右”)管口導進,倘若利用該裝置收集Cl2,試劑瓶中盛放的試劑為 。
C裝置用于處理多余氣體對環境的污染,若利用該裝置吸收Cl2,此時燒杯中發生反應的離子方程式為 。倘若該裝置中僅僅盛放稀硫酸,通常不適合吸收氨氣的原因是 ,若向燒杯中額外再加入一種液態有機物則可安全吸收氨氣,這種有機物為 。
(1)下列實驗操作或對實驗事實的描述不正確的有 (填序號)。
| A.用托盤天平稱量17.55g氯化鈉晶體 |
| B.碳酸鈉溶液保存在帶玻璃塞的試劑瓶 |
| C.用干燥的pH試紙測定新制氯水的pH |
| D.使用容量瓶配制溶液時,俯視刻度線定容后濃度偏大 |


| 氣體 | O2 | Cl2 | NH3 |
| 分液漏斗中試劑 | | | 濃氨水 |
| 圓底燒瓶中試劑 | | KMnO4 | |
(A)實驗室模擬合成氨和氨催化氧化的流程如下:
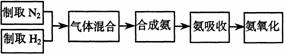

已知實驗室可用飽和亞硝酸鈉(NaNO2)溶液與飽和氯化銨溶液經加熱后反應制取氮氣。
(1) 從下圖中選擇制取氣體的合適裝置:

氮氣 、氫氣
(2)氮氣和氫氣通過甲裝置,甲裝置的作用除了將氣體混合外,還有 、
(3)氨合成器出來經冷卻的氣體連續通人乙裝置的水中吸收氨, (“會”或“不會”)發生倒吸,原因是: 。
(4)用乙裝置吸收一段時間氨后,再通入空氣,同時將經加熱的鉑絲插入乙裝置的錐形瓶內,能使鉑絲保持紅熱的原因是: ,錐形瓶中還可觀察到的現象是: 。
(5)寫出乙裝置中氨氧化的化學方程式:
(6)反應結束后錐形瓶內的溶液中含有H+、OH-、 、 離子。
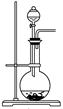
(B)某課外研究小組,用含有較多雜質的銅粉,通過不同的化學反應制取膽礬。其設計的實驗過程為:

(1)銅中含有大量的有機物,可采用灼燒的方法除去有機物,灼燒時將瓷坩堝置于 上(用以下所給儀器的編號填入,下同),取用坩堝應使用 ,灼燒后的坩堝應放在 上,不能直接放在桌面上。
實驗所用儀器:a 蒸發皿 b 石棉網 c 泥三角
d 表面皿 e 坩堝鉗 f 試管夾
(2)雜銅經灼燒后得到的產物是氧化銅及少量銅的混合物,用以制取膽礬。灼燒后含有少量銅的可能原因是
a 灼燒過程中部分氧化銅被還原 b 灼燒不充分銅未被完全氧化
c 氧化銅在加熱過程中分解生成銅 d 該條件下銅無法被氧氣氧化
(3)通過途徑Ⅱ實現用粗制氧化銅制取膽礬,必須進行的實驗操作步驟:酸溶、加熱通氧氣、過濾、 、冷卻結晶、 、自然干燥
(4)由粗制氧化銅通過兩種途徑制取膽礬,與途徑Ⅰ相比,途徑Ⅱ有明顯的兩個優點是: 、
(5)在測定所得膽礬(CuSO4?xH2O)中結晶水x值的實驗過程中:稱量操作至少進行 次
(6)若測定結果x值偏高,可能的原因是
a 加熱溫度過高 b 膽礬晶體的顆粒較大
c 加熱后放在空氣中冷卻 d 膽礬晶體部分風化
| A.用托盤天平稱量17.55g氯化鈉晶體 |
| B.碳酸鈉溶液保存在帶玻璃塞的試劑瓶 |
| C.用干燥的pH試紙測定新制氯水的pH |
| D.使用容量瓶配制溶液時,俯視刻度線定容后濃度偏大 |
| 氣體 | O2 | Cl2 | NH3 |
| 分液漏斗中試劑 | | | 濃氨水 |
| 圓底燒瓶中試劑 | | KMnO4 | |
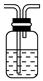
(12分)硫代硫酸鈉(Na2S2O3·5H2O)俗名“大蘇打”,又稱為“海波”。它易溶于水,難溶于乙醇,加熱易分解。工業上常用亞硫酸鈉法、硫化堿法等制備。某實驗室模擬工業硫化堿法制取硫代硫酸鈉,其反應裝置及所需試劑如下圖:實驗具體操作步驟為:
①開啟分液漏斗,使硫酸慢慢滴下,適當調節螺旋夾,使反應產生的SO2氣體較均勻地通入Na2S和Na2CO3的混合溶液中,同時開啟電磁攪拌器攪動。
②至析出的硫不再消失,控制溶液的pH接近
7時,停止通入SO2氣體。
③抽濾所得的濾液,轉移至蒸發皿中,水浴加熱
濃縮,直到溶液表面出現晶膜。
④冷卻結晶、抽濾、洗滌。
⑤將晶體放入烘箱中,在40~45℃左右干燥
50~60min,稱量。
請回答以下問題:
(l)儀器a的名稱是 ;
(2)步驟②中若控制pH值小于7,則產率會下降,請用離子方程式解釋原因: 。
(3)步驟③中不能將溶液蒸發至干的原因是 ;晶膜通常在溶液表面出現的原因是 。
(4)步驟④中洗滌硫代硫酸鈉晶體所用試劑的結構式是 。
(5)為檢驗制得的產品的純度,該實驗小組稱取5,0克的產品配制成250mL硫代硫酸鈉溶液,并用間接碘量法標定該溶液的濃度:在錐形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入過量的KI并酸化,發生下列反應:5I-+IO3-+6H+=3I2+3H2O,再加入幾滴淀粉溶液,立即用所配Na2S2O3溶液滴定,發生反應:I2+2S2O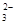 =2I-+S4O
=2I-+S4O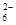 ,當藍色褪去H半分鐘不變色時到達滴定終點。實驗數據如下表:
,當藍色褪去H半分鐘不變色時到達滴定終點。實驗數據如下表:
| 實驗序號 | 1 | 2 | 3 |
| Na2S2O3溶液體積(mL) | 19.98 | 20.02 | 21.18 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com