(2012?海淀區二模)合成氨尿素工業生產過程中涉及到的物質轉化過程如下圖所示.
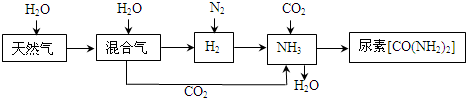
(1)天然氣在高溫、催化劑作用下與水蒸氣反應生成H
2和CO的化學方程式為
.
(2)在合成氨生產中,將生成的氨及時從反應后的氣體中分離出來.運用化學平衡的知識分析這樣做的是否有利于氨的合成,說明理由:
移走氨氣,減小生成物濃度,平衡右移,有利于氨生成
移走氨氣,減小生成物濃度,平衡右移,有利于氨生成
.
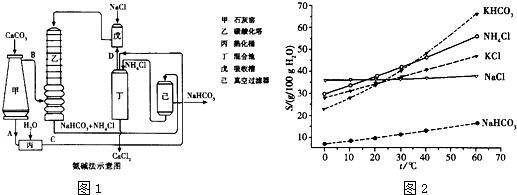
(3)如圖為合成氨反應在不同溫度和壓強、使用相同催化劑條件下,初始時氮氣、氫氣的體積比為1:3時,平衡混合物中氨的體積分數.
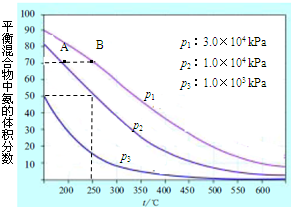
①若分別用υ
A(NH
3)和υ
B(NH
3) 表示從反應開始至達平衡狀態A、B時的化學反應速率,則υ
A(NH
3)
<
<
υ
B(NH
3)(填“>”、“<”或“=”).
②在相同溫度、當壓強由p
1變為p
3時,合成氨反應的化學平衡常數
不變
不變
.(填“變大”、“變小”或“不變”).
③在250℃、1.0×10
4kPa下,H
2的轉化率為
66.7
66.7
%(計算結果保留小數點后1位).
(4)NH
3(g) 與CO
2(g) 經過兩步反應生成尿素,兩步反應的能量變化示意圖如下:
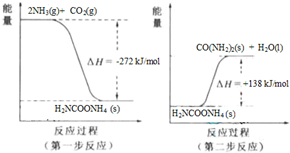
NH
3(g) 與CO
2(g) 反應生成尿素的熱化學方程式為
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
.
(5)運輸氨時,不能使用銅及其合金制造的管道閥門.因為,在潮濕的環境中,金屬銅在有NH
3存在時能被空氣中的O
2氧化,生成Cu(NH
3)
42+,該反應的離子方程式為
2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-
2Cu+8NH3+O2+2H2O═2Cu(NH3)42++4OH-
.

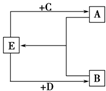 (2)已知A、B、C、D、E五種化合物均由上述元素中的幾種組成.它們之間的轉換關系如圖所示,且A、B、E三種物質含有相同的一種金屬元素,C和D分別是常見的強酸和強堿,則:
(2)已知A、B、C、D、E五種化合物均由上述元素中的幾種組成.它們之間的轉換關系如圖所示,且A、B、E三種物質含有相同的一種金屬元素,C和D分別是常見的強酸和強堿,則:

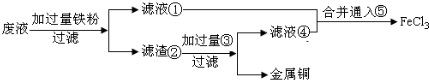
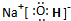
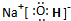

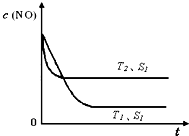 (2012?佛山二模)2012年2月27日深圳宣稱進入“200萬輛汽車時代”,汽車尾氣已成為重要的空氣污染物.
(2012?佛山二模)2012年2月27日深圳宣稱進入“200萬輛汽車時代”,汽車尾氣已成為重要的空氣污染物.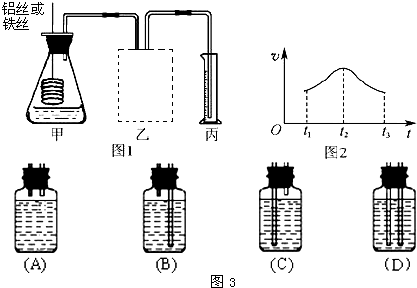


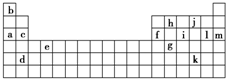 下表是周期表的一部分,表中所列的字母分別代表某一化學元素.
下表是周期表的一部分,表中所列的字母分別代表某一化學元素.


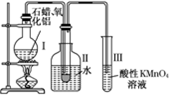 如何從石油中獲得更多的輕質燃油一直是化學家探索的課題,將石油分餾得到的重油進行裂化可以獲得更多的輕質燃油.
如何從石油中獲得更多的輕質燃油一直是化學家探索的課題,將石油分餾得到的重油進行裂化可以獲得更多的輕質燃油. (2010?長春一模)用銅片、銀片、Cu(NO3)2溶液、AgNO3溶液、導線和鹽橋(裝有瓊脂-KNO3的U形管)構成一個原電池(如圖).以下有關該原電池的敘述正確的是
(2010?長春一模)用銅片、銀片、Cu(NO3)2溶液、AgNO3溶液、導線和鹽橋(裝有瓊脂-KNO3的U形管)構成一個原電池(如圖).以下有關該原電池的敘述正確的是