
2000年全國初中學生化學素質和實驗能力競賽
(第十屆天原杯)復賽試題
可能用到的相對原子質量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 K-39 Mn-55 Fe-56 Cu-63.5 Zn-65
一、選擇題(本題15小題,每小題2分,共30分。每小題有1個或2個選項符合題意。若有兩個答案的錯1個不得分, 漏選1個扣1分。請將答案填在下表相應題號的空格內。)
1.氫氣是一種很有前途的能源。以水為原料大量制取氫氣最理想的途徑是
A由熱電站提供電力電解水 B使水與熾熱的鐵反應制取氫氣
C使水與焦炭反應制取氫氣 D利用太陽能分解水
2.下列與人的生理有關的敘述中,不正確的是
A脂肪(由碳、氫、氧元素組成)在人體內代謝的最終產物是CO2和H2O
B劇烈運動時人體代謝加快,代謝產物不能及時排出,血液的pH增大
C人的胃液中含有少量鹽酸,可以幫助消化
D煤氣中毒主要是CO與血紅蛋白牢固結合,使血紅蛋白失去輸氧能力
3.溫室中的綠色植物受陽光的照射生長,晝夜測定溫室內氧氣的含量如下圖所示,其中正確的是
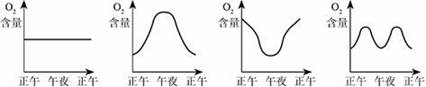
A B C D
4.按照原子核外電子排布規律:各電子層最多容納的電子數為2n2(n為電子層數,其中,最外層電子數不超過8個,次外層不超過18個)。1999年已發現了核電荷數為118的元素,其原子核外電子層排布是
A.2,8,18,32,32,18,8 B.2,8,18,32,50,8
C.2,8,18,32,18,8 D.2,8,18,32,50,18,8
5.某電鍍廠排出的酸性污水中,含有有毒的Cu2+,欲除去Cu2+并降低污水的酸性,加入下列適量的物質時,不能達到目的的是
A純堿 B生石灰 C食鹽 D氧化鐵
6.為完全中和某一強酸溶液,需用10克溶質的質量分數為4%的NaOH溶液。如果改用10克溶質的質量分數為4%的KOH溶液,反應后,溶液的pH
A大于7 B小于7 C等于7 D無法判斷
7.工業品鹽酸中因含有Fe3+而帶黃色,若某工業品鹽酸中H+和Cl-的個數比為91:94,則該鹽酸中Fe3+和Cl-的個數比為
A.1:1 B.1:3 C.91:94 D.1:94
8.在化學反應aZn+bHNO3(稀) = cZn(NO3)2+dNO↑+eH2O中,若e的值為4,則d的值為
A.1 B.2 C.3 D.4
9.向Na2CO3溶液里滴加鹽酸,開始時無氣泡產生,后來才有氣泡產生;向鹽酸里滴加Na2CO3溶液時,立即就有氣泡產生。這說明
A.Na2CO3過量時,主要發生的反應是 Na2CO3+HCl = NaHCO3+NaCl
B.Na2CO3跟鹽酸不反應
C.鹽酸過量時,主要發生的反應是Na2CO3+2HCl =2NaCl+H2O+CO2↑
D.產生的氣泡是揮發出來的氯化氫氣體
10.右圖是某固態物質的溶解度曲線,試判斷該溶液在A、B、C、D四種狀態時,屬于不飽和溶液的是
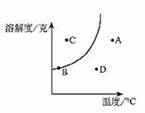
A.A B.B C.C D.D
11.加熱氯酸鉀和二氧化錳的混合物使之完全反應,在t ℃時將殘留固體
加入10克水中,充分攪拌后有7.6克固體未溶;保持溫度不變,再緩慢加入5.0克水恰至固體質量不再變化,此時仍有5.0克固體未溶。則t ℃時氯化鉀的溶解度可能是
A.91.2克 B.65.2克 C.52克 D.15.2克
12.如果在宇宙飛船上劃燃火柴,火焰會立即熄滅,這是由于
A.O2不夠 B.在失重情況下,空氣不對流 C.宇宙飛船上溫度低 D.達不到著火點
13.往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些鐵粉,待反應完成后再過濾,不可能存在的情況是
A.濾紙上有Ag,濾液中有Ag+、Cu2+、Zn2+、Fe2+
B.濾紙上有Ag、Cu,濾液中有Ag+、Zn2+、Fe2+
C.濾紙上有Ag、Cu、Fe,濾液中有Zn2+、Fe2+
D.濾紙上有Ag、Cu、Fe、Zn,濾液中有Zn2+、Fe2+
14.正常人胃液的pH在0.3~1.2之間,酸(一般以鹽酸表示)多了,需要治療。某些用以治療胃酸過多的藥物中含MgCO3、NaHCO3,還有用酒石酸鈉來治療的。這主要是由于
A.碳酸、酒石酸都不是強酸 B.對人體而言酒石酸是營養品
C.Na+、Mg2+都是人體必需的元素
D.MgCO3、NaHCO3與胃酸作用生成CO2,在服藥后有喝汽水的舒服感
15.要除去下列四種物質中的少量雜質(括號內的物質為雜質)
甲:CaCO3 (Na2CO3) 乙:NaOH (Na2CO3) 丙:KCl (KHCO3) 丁:炭粉(CuO)
可選用的試劑及操作方法有:①加適量鹽酸,攪拌,過濾;②加適量水,攪拌,過濾;③加適量鹽酸,蒸發;④溶解,加適量石灰水,過濾,蒸發。下列組合正確的是
A甲-②,乙-④ B乙-③,丙-① C丙-①,丁-② D丁-①,丙-③
二、填空題(本題包括10小題,共36分)
16.日常生活中,用于保護鋼鐵制品(如自來水管)所使用的“銀粉”實際上是金屬 的粉末;家用熱水瓶內膽壁上的金屬是 ;溫度計中填充的金屬是 ;玻璃刀刀頭是用 制成的。

17.冶煉技術在中國有著悠久的歷史,我國古代將爐甘石(ZnCO3)、赤銅礦(主要成分為Cu2O)和木炭粉混合加熱至800 ℃左右,即可得到金光閃閃與黃金外觀相似的“藥金”。
⑴用上述方法不能制得黃金是因為 。
⑵藥金的主要成分是 。
18.在電解水的實驗中,與電池負極相連的試管a得到 ,與電池正極相連的試管b得到 ,兩種氣體的體積比是 。由這一事實可以推知,在同溫同壓下,相同體積的任何兩種氣體中含有的 相同。
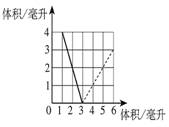
用上面得到的結論分析,右圖是一定體積的氫氣和不同體積的氧氣化合成水(液態)的實驗數據的關系圖(橫坐標表示反應前氧氣的體積,縱坐標表示反應后剩余氣體的體積,氣體體積均在同溫同壓下測定)。試回答:
⑴實線部分表示剩余的氣體是 ;
⑵虛線部分表示剩余的氣體是 ;
⑶實線與虛線的交點表示的意義是 。
⑷反應前原有氫氣 毫升。
19.肥皂的主要成分為硬脂酸鈉(C17H35COONa),它與水中的Ca2+、Mg2+起反應生成硬脂酸鈣和硬脂酸鎂沉淀而不能起泡。現有肥皂水溶液和四種等體積的待測溶液:①蒸餾水;②0.1% CaCl2溶液;③1% CaCl2溶液;④1% MgCl2溶液。試回答:檢驗這四種溶液應選用的方法是 。
20.把m克物質溶于水配成100克溶質的質量分數為n%的溶液。已知A可能是Na2O、P2O5、NaCl、KNO3、Na2CO3?10H2O、CuSO4?5H2O中的一種或兩種。請依據下列要求填空:
⑴當m = n時,A物質是 或 。
⑵當m>n時,A物質是 或 。
⑶當m<n時,A物質是 或 。
21.某學生用右圖所示的裝置,使用較濃的鹽酸跟足量碳酸鈉固體反應,并將所生成的氣體通入石灰水中,開始一段時間內未發現石灰水變渾濁,原因是 ;
將生成的氣體用少量水洗后再通入新換的石灰水中,發現石灰水變渾濁,但很快又變澄清,渾濁現象消失的原因可能是 。

22.為測定硫酸銨和氯化銨混合物中氯化銨的質量分數,甲、乙兩位同學按下列實驗步驟進行實驗:稱量樣品→溶解→加過量試劑A→過濾出沉淀B→洗滌沉淀→烘干稱量→處理實驗數據并得出結果
⑴實驗時,甲同學選用硝酸銀溶液作試劑A,乙同學選用氯化鋇溶液作試劑A,其中 同學所選擇的試劑A不合理,理由是 。
⑵以下都是在試劑A選擇正確時進行的實驗:
①為進行稱量、溶解、反應、過濾、洗滌沉淀的各項操作,準備了以下儀器:托盤天平與砝碼、燒杯、過濾器、鐵架臺及附件、膠頭滴管、量筒。其中還缺少的一件必備的儀器是 。
②若過濾所得沉淀未經洗滌即烘干稱量,測定結果將 (填“偏高”、“偏低”)。
③若實驗測得混合物的質量為w克,沉淀物的質量為m克,實驗測定的氯化銨質量分數的計算式= 。
23.下列四種物質在水(20 ℃)、液氨(低溫)中各自的溶解度(克/100克溶劑)如下表所示:
在水或液氨中,這四種化合物中的某兩種可能發生復分解反應,其化學方程式分別為:
在水中 ;
在液氨中 。
24.有一包白色粉末,可能是CuSO4、CaCO3、BaCl2、Na2SO4、KOH中的一種或幾種,為證明其組成,進行如下實驗:
⑴取少量白色粉末,向其中加入足量的水,充分攪拌后過濾,得到白色沉淀和無色濾液,則白色沉淀可能是 ,原混合物中一定不含有 。
⑵向實驗(1)濾出的白色沉淀中加入足量的鹽酸,沉淀全部溶解,并產生無色氣體。則原混合物中一定含有 。
⑶將實驗⑴中得到的濾液分成兩份,將實驗⑵中產生的無色氣體先通入其中的一份,無沉淀產生。氣體導出后再通入另一份濾液中,立即產生白色沉淀,再過濾。出現上述現象的原因是實驗⑵中產生的氣體里含有 。
⑷向實驗⑶中過濾后所得的濾液里加入AgNO3溶液和稀硝酸,又產生白色沉淀,根據此現象推斷,原混合物中一定還含有 ,根據實驗全過程推斷,原混合物中還含有 。
25.某學生在課外活動中用一定量的二價金屬R和稀硫酸反應來制取氫氣,所做5次實驗結果記錄如下表(假設每次實驗所產生的氫氣全部被收集,體積在同溫同壓下測定)。根據上述實驗結果進行分析、計算,并回答下列問題:
⑴上述實驗中,金屬一定過量的組的編號是 ,稀硫酸一定過量的組的編號是 。
⑵若在當時實驗條件下,H2的密度為0.085克/升,則反應所用金屬R的相對原子質量為 。
⑶若所使用的稀硫酸密度為1.12克/厘米3,則反應所用的硫酸溶液中溶質的質量分數為 。
三、實驗題(共22分)
26.銅綠的主要成分是堿式碳酸銅〔Cu2(OH)2CO3〕,它能跟酸反應生成銅鹽、水和二氧化碳。某同學用小刀把家中舊銅器上的銅綠刮下,用來依次制取較純凈的硫酸銅、氧化銅和銅(為避免摻入固體雜質,他沒有采用金屬或碳置換化合物中的銅的方法)。制取步驟分為四步:
⑴填寫下面表示制取步驟和方法的方框圖(方框內填寫所制取物質的化學式,方框前的橫線上填寫所加入的試劑及簡要操作)。
銅綠
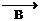
Cu(OH)2
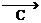
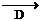
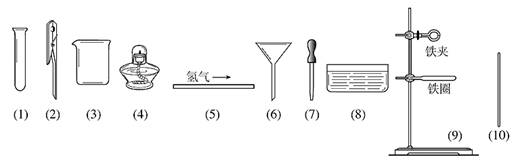
⑵根據上面的操作步驟,在下列所示儀器中選擇實驗所需用的儀器編號和名稱:
⑶寫出A、C操作過程中涉及的反應的化學方程式:
。
⑷如果實驗裝置及生成銅以前的操作都正確,但最后沒有生成銅,這是因為 。
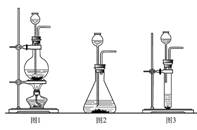
27.超氧化鉀(KO2)是一種黃色固體,它能與二氧化碳反應生成氧氣,在潛水艇中用它作制氧劑,供人們呼吸之用。它與二氧化碳反應的化學方程式為4KO2+2CO2 = 2K2CO3+3O2,某學生為了驗證這一實驗,以大理石、足量的鹽酸和超氧化鉀為原料制取O2,設計出如下實驗裝置:

⑴A是制取CO2的裝置,應從下列圖1、圖2、圖3中選擇 。B裝置的作用是吸收A裝置中產生的鹽酸酸霧,C裝置內可能出現的現象是 。為了檢驗E中收集到的氣體,可以在取出集氣瓶后,用 的木條伸入集氣瓶內,木條會 。
⑵若E中的石灰水出現少量的白色沉淀,這是因為 。
⑶表明D中的超氧化鉀樣品接近反應完畢時的現象是 。
四、計算題(共12分)
28.如下圖所示,A管中盛有干燥的炭粉,C管中盛有干燥的氧化銅粉末,B、D兩個U型管中裝有氫氧化鈉和氧化鈣的固體混合物,用來充分吸收二氧化碳氣體。將3.0克干燥的二氧化碳氣體全部通入A管進行實驗,實驗結束后,B管質量增加0.8克,D管質量增加3.3克,計算進入C管和離開C管的一氧化碳的質量各為多少?

29.20.0克CuO溶于123.5克溫熱的20.0% H2SO4溶液。冷卻到20 ℃時能從溶液中析出多少克CuSO4? 5H2O晶體?(20 ℃時CuSO4的溶解度為20.7克/100克水)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com