
| A. | ①③⑤ | B. | ②③④ | C. | ②④⑤ | D. | ①④⑤ |
分析 ①二硫化亞鐵和氧氣反應生成二氧化硫,二氧化硫具有還原性,能被氧化劑氧化;
②二氧化硅和HCl不反應;
③飽和氯化鈉溶液中通入氨氣和二氧化碳,氨氣、二氧化碳和水反應生成碳酸氫銨,碳酸氫鈉的溶解度小于氯化鈉;碳酸氫鈉不穩定,受熱易分解生成碳酸鈉;
④實驗室用濃鹽酸和二氧化錳加熱制取氯氣;
⑤硫酸銅中加入過量氫氧化鈉生成氫氧化銅懸濁液,氫氧化銅能檢驗醛基.
解答 解:①二硫化亞鐵和氧氣反應生成二氧化硫,二氧化硫具有還原性,能被氧化劑雙氧水氧化生成硫酸,所以能一步實現,故正確;
②二氧化硅和HCl不反應,所以不能一步實現,故錯誤;
③飽和氯化鈉溶液中通入氨氣和二氧化碳,氨氣、二氧化碳和水反應生成碳酸氫銨,碳酸氫鈉的溶解度小于氯化鈉;碳酸氫鈉不穩定,受熱易分解生成碳酸鈉,所以能一步實現,故正確;
④實驗室用濃鹽酸和二氧化錳加熱制取氯氣,1mol/LHCl是稀鹽酸,所以不能制取氯氣,所以不能一步實現,故錯誤;
⑤硫酸銅中加入過量氫氧化鈉生成氫氧化銅懸濁液,氫氧化銅能檢驗醛基,葡萄糖中含有醛基,葡萄糖和新制氫氧化銅懸濁液發生氧化反應生成磚紅色氧化亞銅,所以能一步實現,故正確;
故選A.
點評 本題考查物質之間的轉化,明確物質的性質是解本題關鍵,注意物質的特殊性質,如HF能和二氧化硅反應但HCl和二氧化硅不反應等,為易錯點.


 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,屬于分子晶體(填晶體類型).
,屬于分子晶體(填晶體類型).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 如果某化合物只含共價鍵,則其一定是共價化合物 | |
| B. | 焓變小于0而熵變大于0的反應肯定是自發反應 | |
| C. | 對于給定條件下反應物之間同時發生多個反應的情況,理想的催化劑可以大幅度提高目標產物在最終產物中的比率 | |
| D. | 綠色化學的核心是利用化學原理對產生的環境污染進行治理 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使甲基橙變紅色的溶液中:K+、Na+、SO42-、CO32- | |
| B. | pH=14的溶液中:K+、Na+、Cl-、AlO2- | |
| C. | 0.1 mol•L-1NH4I溶液中:Na+、Fe3+、Cl-、SO42- | |
| D. | 與鋁反應產生大量氫氣的溶液中:Na+、NH4+、HCO3-、NO3- |
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省長沙市高三上學期第三次月考模擬化學試卷 題型:選擇題
A~E是中學常見的5種化合物,A、B是氧化物,它們之間的轉化關系如圖所示。
則下列說法正確
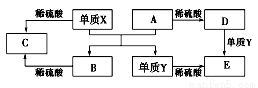
A.單質X與A反應的化學方程式:Al2O3+2Fe Fe2O3+2Al
Fe2O3+2Al
B.檢驗D溶液中金屬陽離子的反應:Fe3++3SCN-=Fe(SCN)3↓
C.單質Y在一定條件下能與水發生置換反應
D.由于化合物B和C均既能與酸反應.又能與堿反應,所以兩者均是兩性化合物
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
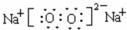 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com