
科目: 來源: 題型:
鋼鐵發生吸氧腐蝕時,正極上發生的反應是
A.2Fe-4e— =2Fe2+ B.2Fe2++4e— =2Fe
C.2H2O+O2+4e—=4OH— D.Fe3++e—=Fe2+
查看答案和解析>>
科目: 來源: 題型:
一定量的某有機物完全燃燒后,將燃燒產物通過足量的澄清石灰水,經過濾可得沉淀10g,但稱量濾液時,其質量比反應前減少2.9g,則此有機物可能是
乙烯 B、丙三醇 C、乙醇 D、乙酸
查看答案和解析>>
科目: 來源: 題型:
填空題
(1)標況下 0.5 mol臭氧(O3)中含有O3的分子數目是 含有O原子的物質的量為 所占的體積為 。
(2)下列物質:①Na ②Na2O ③CO2 ④NH3 ⑤HCl ⑥H2SO4 ⑦Ba(OH)2 ⑧蔗糖 ⑨NaCl溶液。
屬于電解質的是 , 屬于非電解質的是 ,能導電的是 。
(3)在Fe2O3 +3CO![]() 2Fe+3CO2的的中, 是氧化劑, 是還原劑, 元素被氧化, 元素被還原。
2Fe+3CO2的的中, 是氧化劑, 是還原劑, 元素被氧化, 元素被還原。
查看答案和解析>>
科目: 來源: 題型:
化學工作者把烷烴、烯烴、炔烴……轉化成鍵數的通式給研究有機物分子中鍵能大小的規律帶來了很大方便。設鍵數為I,則烷烴中碳原子跟鍵數關系的通式為CnI3n+1,烯烴(視雙鍵為兩條單鍵)和環烷烴中碳原子跟鍵數關系的通式為CnI3n,則苯的同系物中碳原子跟鍵數關系的通式為
A. CnI3n-1 B. CnI3n-2 C. CnI3n-3 D. CnI3n-4
查看答案和解析>>
科目: 來源: 題型:
研究發現,奧司他韋可以有效治療H1N1 流感,奧司他韋分子式為C16H28N2O4·H3PO4,分子結構如圖。下列有關奧司他韋的說法中正確的是

A.含極性鍵,易溶于水,其水溶液有丁達爾效應
B.分子中含有酯基、氨基、苯環等官能團
C.1mol 該物質最多能與3molNaOH反應
D.可以發生加成、取代、氧化反應、還原反應
查看答案和解析>>
科目: 來源: 題型:閱讀理解
Fe在地殼中的含量雖次于鋁,但鐵及其化合物在生活、生產中的應用最廣泛。請回答下列問題:
(1)Na2FeO4是一種高效多功能水處理劑,應用前景廣闊。一種制備鐵酸鈉的方法可用化學方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,對此反應下列說法中正確的是
A.Na2O2在反應中只作氧化劑
B.Na2FeO4既是氧化物又是還原產物
C.O2是還原產物
D.2molFeSO4發生反應時,反應中共有8mol電子轉移
(2)硫酸亞鐵晶體(FeSO4·7H2O),俗稱“綠礬”,常作醫藥上的補血劑。課外研究性小組測定某片狀補血藥品中鐵元素的含量。實驗步驟如下:

請回答下列問題:
①該小組發現將片狀補血劑長時間置于空氣中,表面“發黃”,請用化學方程式表示原因 。
②課外研究性小組發現在濾液A中滴入少量KClO溶液,并加入適量硫酸,溶液立即變黃。
甲同學推測該反應的還原產物有兩種可能:①Cl2、②Cl-
乙同學結合甲的推測,認為其中一種可能可以排除,你認為可以排除的是(填序號) ;用離子方程式說明理由 。
③若該實驗溫度下,上述紅褐色難溶物質的溶度積為![]() 試計算該物質沉淀完全所需要的pH= (要求保留2位有效數字)(已知溶液中離子濃度小于10-5mol/L時,該離子可看做沉淀完全,lg2=0.3)
試計算該物質沉淀完全所需要的pH= (要求保留2位有效數字)(已知溶液中離子濃度小于10-5mol/L時,該離子可看做沉淀完全,lg2=0.3)
④若實驗過程中無損耗,最后稱量得到mg紅棕色的固體,則每片補血劑中含鐵元素的質量為 g(用含m的式子表示)
⑤丙同學認為蒸干灼燒溶液B,也可以制得紅棕色固體C,請結合化學方程式加以說明
。
查看答案和解析>>
科目: 來源: 題型:
室溫下,下列溶液等體積混和,所得溶液pH的一定大于7的是
A、0.1mol.l-1鹽酸溶液和0.1mol.l-1氫氧化鈉溶液
B、0.1mol.l-1鹽酸溶液和0.1mol.l-1氫氧化鋇溶液
C 、pH =4醋酸溶液和pH =10氫氧化鈉溶液
D、 pH =4鹽酸溶液和pH =10氫氧化鋇溶液
查看答案和解析>>
科目: 來源: 題型:
在中學化學實驗中,對某些化學試劑進行循環使用,可以節省資源、減少污染、降低實驗成本,下列做法合理的是
| 編號 | 實驗名稱 | 回收試劑 | 回收方法 | 回收后用途 |
| ① | 實驗室制氧氣 | 二氧化錳 | 溶解、過濾、洗滌、干燥 | 重復使用 |
| ② | 氫氧化亞鐵制備 | 氫氧化亞鐵 | 直接密封保存 | 制硫酸亞鐵 |
| ③ | 萃取 | 四氯化碳 | 堿液洗滌、分液 | 重復使用 |
| ④ | 硫酸銅結晶 水含量測定 | 無水硫酸銅 | 直接密封保存 | 水蒸氣檢驗 |
| ⑤ | 濃硫酸的稀釋 | 稀硫酸 | 直接密封保存 | 制氫氣、硫酸根檢驗等 |
A.①③④⑤ B.①②③④⑤ C.①③⑤ D.①②④⑤
查看答案和解析>>
科目: 來源: 題型:閱讀理解
實驗室用銅制取硫酸銅,將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使之反應完全,通過蒸發、結晶得到硫酸銅晶體。
(1)為了節約原料,硫酸和硝酸的物質的量之比最佳為: : ;
為了吸收該反應中產生的尾氣,請選擇下列中合適的裝置 。
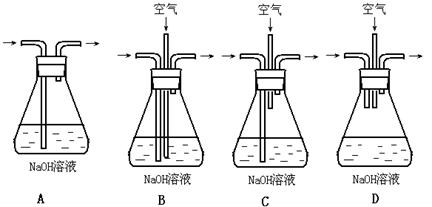
(2)為符合綠色化學的要求,某研究性學習小組進行如下設計:
第一組:以空氣為氧化劑法
方案1:以空氣為氧化劑。將銅粉在儀器B中反復灼燒,使銅與空氣充分反應生成氧化銅,再將氧化銅與稀硫酸反應。
方案2:將空氣或氧氣直接通入到銅粉與稀硫酸的混合物中,發現在常溫下幾乎不反應。向反應液中加少量FeSO4,即發生反應,生成硫酸銅。反應完全后,加物質甲調節pH ,鐵元素全部沉淀(一般認為鐵離子的濃度下降到10-5 mol·L-1,就認為沉淀完全),然后過濾、濃縮、結晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
請回答下列問題:
如開始加入的銅粉為3.2 g,最后所得溶液為500 mL,溶液中含有鐵元素0.005 mol。①方案1中的B儀器名稱是 。
②為了使鐵元素全部沉淀,應調節pH至少為_________。
③方案2中甲物質可選用的是 。
A、CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反應中加入少量FeSO4可加速銅的氧化,用離子方程式解釋其原因 。
第二組:過氧化氫為氧化劑法
將3.2g銅絲放到45 mL 1.5mol·L-1的稀硫酸中,控溫在50℃。加入18mL 10%的H2O2,反應0.5h,升溫到60℃,持續反應1 h后,過濾、蒸發濃縮、減壓抽濾等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5g。
請回答下列問題:
⑤反應時溫度控制在50℃~60℃不宜過高的原因是 ,
⑥本實驗CuSO4·5H2O的產率為 。
查看答案和解析>>
科目: 來源: 題型:
0.1 mol某烴在足量的氧氣中完全燃燒,生成CO2和水各0.6 mol,則該烴的分子式為_________________。若該烴不能使溴水或高錳酸鉀溶液褪色,但在一定條件下,可以和液溴發生取代反應,其一溴取代物只有一種,則此烴的結構簡式為_________________,名稱是_________________ 。
若該烴能使溴水褪色,且能在催化劑作用下與H2發生加成反應,生成2.2—二甲基丁烷,則此烴屬于_______ 烴,結構簡式為_______________,名稱是 _________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com