
科目: 來源: 題型:
小美在奧運五連環中填入了5種物質,相連環物質間能發生反應,不相連環物質間不能發生反應。你認為“五連環”中物質間發生的反應,沒有涉及的基本反應類型和屬于氧化還原反應的個數有
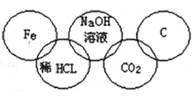
A.復分解反應、1個 B.分解反應、2個
C.化合反應、3個 D.置換反應、2個
查看答案和解析>>
科目: 來源: 題型:
下列說法正確的是
A.1 L水中溶解了58.5 g NaCl,該溶液的物質的量濃度為1 mol/L
B.從1 L 2 mol/L的H2SO4溶液中取出0.5 L,該溶液中氫離子的濃度為2 mol/L
C.配制480 mL 0.5 mol/L的CuSO4溶液,需稱取62.5 g膽礬
D.中和100 mL 1mol/L的H2SO4溶液,需NaOH為4 g
查看答案和解析>>
科目: 來源: 題型:閱讀理解
新制氯水中含有多種粒子,某校化學研究性學習小組的同學為探究其性質,做了如下實驗,請你幫助完成:
(1)氯氣能使濕潤的紅色布條褪色。使其褪色的微粒的化學式是______
(2)將氯水在光照上一段時間,溶液顏色逐漸變淺,其有關反應的化學方程式為:
、
(3)平衡常數表明了封閉體系的可逆反應在給定的溫度下進行的程度,對于同一個類型的反應,平衡常數越大,表明反應進行的程度越大。
H2CO3 ![]()
![]() + H+ Ka1(H2CO3)=4.45×10—7
+ H+ Ka1(H2CO3)=4.45×10—7
![]()
![]()
![]() +H+ Ka2(HCO3-)=5.61×10-11
+H+ Ka2(HCO3-)=5.61×10-11
HclO ![]() H++
H++![]() Ka(HClO)=2.95×10-8
Ka(HClO)=2.95×10-8
請依據以上電離平衡常數,請寫出將少量的氯氣通入到過量的碳酸鈉溶液中所發生反應的離子方程式:
(4)飽和氯水與石灰石的反應是制取較濃HClO溶液的方法之一。

實驗一、定性研究:
在試管中加入過量的塊狀碳酸鈣,再加入約20mL飽和氯水,充分反應,
有少量氣泡產生,溶液淺黃綠色褪去;
② 過濾,將濾液滴在有色布條上,發現其比氯水的漂白性更強;
③ 為了確定反應產物,將濾液分為三份,分別進行以下實驗:
第一份與石灰水混合,立即產生大量白色沉淀;
第二份與稀鹽酸混合,立即產生大量無色氣體;
將第三份加熱,看到溶液變渾濁且有大量無色氣體產生。
經檢測,上述實驗中產生的無色氣體均為CO2。
請回答:
① 反應后所得的溶液漂白性增強的原因是______ ___________ ____
②依據上述實驗可推知:②的濾液中的溶質除CaCl2、HClO外,還含有______ _ 。
實驗二、定量研究:
在圓底燒瓶底部,有一用塑料網包住的過量塊狀 碳酸鈣和150mL飽和氯水,按如圖所示裝置實驗,待不再產生氣泡后,將塑料網中剩余的石灰石提出液面,密封后再加熱、煮沸燒瓶中的液體,直到量筒中的氣體不再增加(不考慮HClO的分解)。
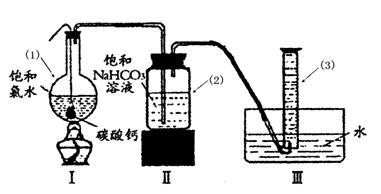
請回答:
③ 寫出儀器(1)與儀器(3)的名稱
(1) (3)
④ 為減少用裝置Ⅲ收集氣體過程中CO2因溶解而造成的損失,且水槽中仍然為水,請你對裝置Ⅲ進行改進,最簡單的方法是 。
⑤ 如何準確讀出量筒中氣體的體積
a________ _
b 上下移動量筒至量筒內液面與水槽液面相平
c
查看答案和解析>>
科目: 來源: 題型:
在強酸性溶液中,能大量共存的離子組是 ( )
A.NH4+ 、Na+ 、Cl-、SO42- B.Cu2+、Ca2+ 、CO32- 、Cl-
C.Al3+、 Ag+ 、NO3-、Cl- D.K+、HCO3-、Cl-、 Na+
查看答案和解析>>
科目: 來源: 題型:
有10.2克鎂鋁合金恰好溶于250mL 4mol·L-1的鹽酸中,現加入2mol·L-1的氫氧化鈉溶液。請回答:
(1)要使產生的沉淀的質量最大,需加入的氫氧化鈉溶液的體積是 mL
(2)要使產生的沉淀只有氫氧化鎂,至少需加入的氫氧化鈉溶液的體積是 mL
查看答案和解析>>
科目: 來源: 題型:
檢驗銨鹽溶液的方法是:將待測物質取出少量,放在試管中,然后( )
A.加熱,用蘸有濃鹽酸的玻璃棒置于試管口檢驗
B.加熱,用濕潤的紅色石蕊試紙置于試管口檢驗
C.加強堿溶液后加熱,再滴入無色酚酞試液
D.加燒堿溶液后加熱,再用濕潤的紅色石蕊試紙置于試管口檢驗
查看答案和解析>>
科目: 來源: 題型:
下列離子方程式書寫正確的是( )
A.明礬溶液與氫氧化鋇溶液反應,使SO恰好完全沉淀:Al3++2SO+2Ba2++3OH-===2BaSO4↓+Al(OH)3↓
B.向FeBr2溶液中通入過量氯氣:2Fe2++Cl2===2Fe3++2Cl-
C.用鉑電極電解MgCl2溶液時發生的反應:2Cl-+2H2OCl2↑+H2↑+2OH-
D.常溫下將硝酸銨溶液與KOH溶液混合:NH+OH-===NH3·H2O
查看答案和解析>>
科目: 來源: 題型:
疊氮化合物應用廣泛,如NaN3可用于汽車安全氣囊,Hg(N3)2可作雷管的起爆劑,工業上制備NaN3的化學反應為:
I.N2H4(聯氨) + HNO2 → HN3(疊氮酸) + H2O (未配平);
II.HN3 + NaOH →NaN3 + H2O
⑴上述反應I中,每生成4.3g HN3時,消耗聯氨的物質的量為 ,NaN3受撞擊時迅速分解為兩種單質,該反應的化學方程式為 。
⑵ 聯氨的電子式為 。
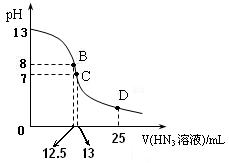
⑶ 上圖為常溫下向25mL、0.1mol/L NaOH溶液中逐滴滴加0.2mol/L的HN3溶液的過程中溶液pH的變化曲線。(溶液混合時體積的變化忽略不計)
① D點時溶液中各離子的濃度由大到小的順序為
② B點時溶液中c (HN3) =
查看答案和解析>>
科目: 來源: 題型:
下列判斷錯誤的是( )
A.沸點: NH3>PH3 >AsH3 B.熔點: Si3N4 > NaCl > Si I4
C.酸性:HClO4>H2SO4>H3PO4 D.堿性:NaOH > Mg(OH)2 > Al(OH)3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com