
科目: 來源: 題型:
根據元素周期表及周期律的知識回答下列問題:
(1)與鈉同周期且單質熔點最高的元素位于周期表的第_________周期第_________族。
(2)金屬鈉在一定條件下可與氫氣反應生成氫化鈉(2Na+H22NaH)。生成物氫化鈉的電子式為________,含有的化學鍵為_____鍵(填“離子”、“共價”或“金屬”)。
(3)元素周期表中元素的性質存在遞變規律,下列比較正確的是??????________。
a.離子半徑:Na+>Mg2+>S2->Cl-
b.酸性:H4SiO4>H3PO4>H2SO4>HClO4
c.氫化物穩定性:PH3<H2S<HCl
d. 還原性:PH3>H2S>HCl>HF
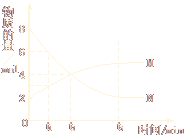
(4)第三周期元素的氣態原子失去最外層一個電子所需能量(設為E)如下圖所示:

① 同周期內,隨著原子序數的增大,E值變化的總趨勢是__________________。
② 根據上圖提供的信息,試推斷E氟_______E氧(填“>”“<”或“=”)。
查看答案和解析>>
科目: 來源: 題型:
被譽為“光纖之父”的華人科學家高錕榮獲2009年諾貝爾化學獎。下列敘述錯誤的是( )
A.SiO2是生產光導纖維的主要原料
B.SiO2與CO2(干冰)的晶體結構不同
C.干冰和SiO2固體熔化時破壞的作用力是相同的
D.二氧化硅晶體中不存在SiO2分子,因為它含有類似金剛石的空間網狀結構
查看答案和解析>>
科目: 來源: 題型:
已知熱化學方程式:SO2(g)+1/2O2 (g)![]() SO3(g) △H=-98.32kJ??mol—1,
SO3(g) △H=-98.32kJ??mol—1,
在容器中充入2molSO2和1molO2充分反應,最終放出的熱量為
A.196.64kJ B.98.32kJ C.<196.64kJ D.>196.64kJ
查看答案和解析>>
科目: 來源: 題型:
在一定溫度下,容器內某一反應中M、N的物質的量隨反應時間變化的曲線如下圖,下列表述中正確的是 ( )
A.反應的化學方程式為:2M![]() N B.t2時,正逆反應速率相等,達到平衡
N B.t2時,正逆反應速率相等,達到平衡
C.t3時,正反應速率大于逆反應速率 D.t1時,N的濃度是M濃度的2倍
查看答案和解析>>
科目: 來源: 題型:
 下表為元素周期表的一部分。請回答下列問題:
下表為元素周期表的一部分。請回答下列問題:
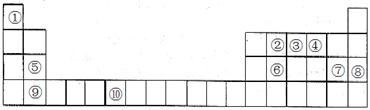
(1)上述元素中,屬于s區的是________________________(填元素符號)。
(2)寫出元素⑩的基態原子的電子排布式___________________________。
(3)元素第一電離能為⑤________________________⑨(填“大于”或“小于”)。
(4)元素③氣態氫化物的中心原子有________________________對弧對電子,其VSEPR模型為________________________;中心原子的雜化類型為_______________;該分子為_________________分子(填“極性”或“非極性”)。向AgNO3溶液中逐滴加入其水溶液,可觀察到的現象為_____________ ___________。
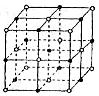
(5)元素⑦的鈉鹽晶胞結構如上圖所示,每個Na+周圍與之距離最近的Na+的個數為________________________。若設該晶胞的棱長為a cm,阿伏加德羅常數的值為NA,則該鈉鹽的密度為________________________(寫出計算式)。
查看答案和解析>>
科目: 來源: 題型:
下列說法正確的是
A. HF、HCl、HBr、HI的熔點沸點依次升高。
B. H2O的熔點、沸點大于H2S的是由于H2O分子之間存在氫鍵。
C. 乙醇分子與水分子之間只存在范德華力。
D. 氯的各種含氧酸的酸性由強到弱排列為HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目: 來源: 題型:
把500 ![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸鈉的溶液,恰好使鋇離子完全沉淀;另取一份加入含
硫酸鈉的溶液,恰好使鋇離子完全沉淀;另取一份加入含![]()
![]() 硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
硝酸銀的溶液,恰好使氯離子完全沉淀。則該混合溶液中鉀離子濃度為
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目: 來源: 題型:
2010年在上海舉辦的世博會將主打環保牌,20輛氫燃料電池公交車、300輛氫燃料電池出租車將投入運行,它們以氫氣為能源,實現了真正的零污染。氫氧燃料電池的電解液為KOH溶液,下列有關該電池的敘述不正確的是
A.正極反應式為:O2+2H2O+4e-=4OH-
B.工作一段時間后,電解液中KOH的物質的量濃度不變
C.該燃料電池的總反應方程式為:2H2+O2=2H2O
D.用該電池電解CuCl2溶液,產生2.24LCl2(標準狀況)時,有0.2mol電子轉移
查看答案和解析>>
科目: 來源: 題型:
下列有關實驗操作的敘述正確的是( )
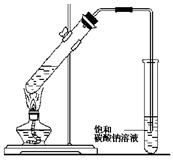
A.實驗室常用上圖所示的裝置制取少量的乙酸乙酯。
B.用50mL酸式滴定管可準確量取 25.00mLKMnO4 溶液
C.用量筒量取5.00 mL1.00mol·L-1鹽酸于50mL 容量瓶
中,加水稀釋至刻度,可配制0.100mol·L-1鹽酸。
D.用苯萃取溴水中的溴,分液時有機層從分液漏斗
的下端放出
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com