
科目: 來源: 題型:
由下列實驗事實得出的結論正確的是
| 實驗事實 | 結論 | |
| A |
|
|
| B | 在空氣中 | 酸性: |
| C |
| 酸性: |
| D | 常溫下白磷可自燃而氮氣須在放電時才與氧氣反應 | 非金屬性: |
查看答案和解析>>
科目: 來源: 題型:
短周期主族元素A、B、C、D、E,原子序數依次增大,A元素的單質常溫常壓下是最輕的氣體,B元素所形成化合物種類最多,C的最高價氧化物對應水化物甲與其氣態氫化物乙能夠化合形成鹽丙;D元素的離子半徑是同周期元素形成的簡單離子中最小的。
(1)已知相關物質之間存在如下變化:
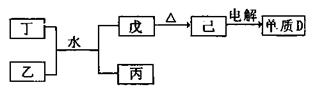
①丁與乙和水反應生成戊和丙的離子方程式為 ,由物質己電解得到單質D的化學方程式為 ;
②0.1mol/L的丙溶液中所含離子濃度由大到小排列順序為 ;常溫下,為使丙溶液中由丙電離的陰、陽離子濃度相等,應向溶液中加入一定量的乙的水溶液至 。
(2)已知E及其化合物有以下變化:
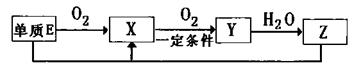
寫出單質E與化合物Z在一定條件下反應生成X和水的化學方程式___ _,由A、B、C、D、E5種元素中的兩種元素,可形成既含極性鍵又含非極性鍵的18電子的分子,該分子的分子式為 (任寫一個即可)。
(3)C有多種氧化物,其中之一是一種無色氣體,在空氣中迅速變成紅棕色,在一定條件下,2L的該無色氣體與0.5 L的氧氣相混合,若該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,所生成的C的含氧酸鹽的化學式是 。
查看答案和解析>>
科目: 來源: 題型:
(10)分)
軟質隱形眼鏡材料W、化合物E,以及樹脂X的合成路線如下:
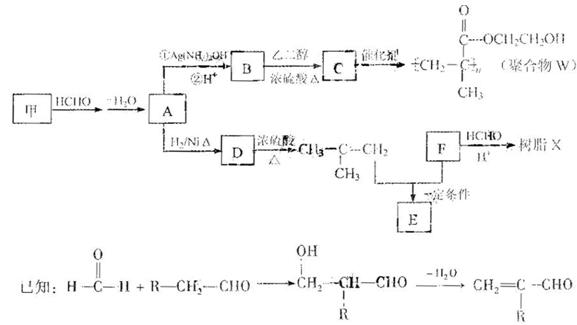
(1)A中含有的官能團名稱是_______
(2)甲的結構簡式是_______
(3)B — C的化學方程式是______________
(4)B有多種同分異構體。屬于酯且含有碳碳雙鍵的同分異構體共有_______種(不考慮順反異構,下同),寫出其中能發生銀鏡反應,且含有甲基所有同分異構體的結構簡式______________
(5)已知F的相對分子質量為110,分子中碳原子、氫原子數都是氧原子數的3倍,笨環上的氫原子化學環境都相同。則F還能發生的反應類型是(填序號) _______。
a.加成反應 b.氧化反應 c.加聚反應 d.水解反應
(6)寫出樹脂X可能的結構簡式(寫出一種即可) _______。
(7)E的分子式為C10H14O2,含三個甲基,苯環上的一溴代物有兩種。生成E的化學方程式是_______
查看答案和解析>>
科目: 來源: 題型:
關于圖中各裝置的敘述不正確的是
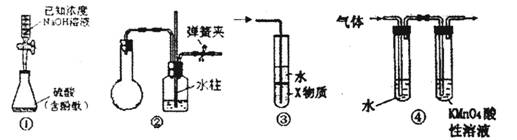
A. 裝置①是中和滴定法測定硫酸的物質的量濃度
B. 裝置②中手捂燒瓶(橡膠管已被彈簧夾夾緊),發現導管中有液柱上升并保持穩定,則說明裝置不漏氣
C. 裝置③中X若為四氯化碳,可用于吸收氨氣,并防止倒吸
D. 裝置④可檢驗溴乙烷發生消去反應得到的氣體中含有乙烯(假定每個裝置中吸收完全)
查看答案和解析>>
科目: 來源: 題型:
現有M、N、P、E 4種元素的單質,能發生以下反應:
①在水溶液中,M+N2+===M2++N ②P+2H2O(冷)===P(OH)2+H2↑ ③N、E相連浸入稀H2SO4中,電極反應為:N-2e-===N2+,2H++2e-===H2↑ 判斷它們的還原性由強到弱的順序是
A.M、N、P、E B.P、M、N、E
C.M、N、E、P D.E、P、M、N
查看答案和解析>>
科目: 來源: 題型:
下列指定微粒的個數比為2:1的是
A. Be2+離子中的質子和電子 B. 21H原子中的中子和質子
C. NaHCO3晶體中的陽離子和陰離子 D. BaO2(過氧化鋇)固體中的陰離子和陽離子
查看答案和解析>>
科目: 來源: 題型:
根據中學化學教材所附元素周期表判斷,下列敘述不正確的是
A.若周期表中第七周期完全排滿共有32種元素
B.周期表中共有18個列,其中形成化合物種類最多的在第14列
C.除過渡元素外周期表中最外層電子數相同的元素都位于同一族中
D.L層電子為奇數的所有元素所在族的序數與該元素原子的L層電子數相等
查看答案和解析>>
科目: 來源: 題型:閱讀理解
I.描述弱電解質電離情況可以用電離度和電離平衡常數表示,下表1是常溫下幾種弱酸的電離平衡常數(Ka)和弱堿的電離平衡常數(Kb)。表1
| 酸或堿 | 電離平衡常數(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
請回答下列問題:
(1)上述四種酸中,酸性最弱的是 (用化學式表示)。下列能使醋酸溶液中CH3COOH的電離程度增大,而電離平衡常數不變的操作是 (填序號)。
A.升高溫度 B.加水稀釋 C.加少量的CH3COONa固體 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (選填“酸性”“中性”或“堿性”),理由是:
,
溶液中各離子濃度大小的關系是 。
II.氮是地球上含量最豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用。請回答下列問題:(圖中涉及物質為氣態)

(1)上圖是1 mol NO2和1mol CO反應生成CO2和NO過程中能量變化示意圖,請寫出NO2和CO反應的熱化學方程式 。
(2)在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下化學反應:
N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化學平衡常數K與溫度t的關系如下表:請完成下列問題。
2NH3(g)△H<0,其化學平衡常數K與溫度t的關系如下表:請完成下列問題。
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①試比較K1、K2的大小,K1_ K2(填寫“>”、“=”或“<”)。
②下列各項能作為判斷該反應達到化學平衡狀態的依據是____(填序號字母):
a.容器內N2、H2、NH3的濃度之比為1:3:2 b.v(N2)正=3v(H2)逆
c.容器內壓強保持不變 d.混合氣體的密度保持不變
③在400℃時, 當測得NH3和N2、H2的物質的量分別為1mol和2mol、3mol時,則該反應的v(N2)正_ _ v(N2)逆(填寫“>”、“=”或“<”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com