
科目: 來源: 題型:
乙酸乙酯是重要的有機合成中間體,廣泛應用于化學工業。實驗室用無水乙醇與乙酸制備乙酸乙酯的化學方程式如下:
CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)該反應的平衡常數表達式K= 。
(2)為證明濃硫酸在該反應中起到了催化劑和吸水劑的作用,某同學利用右圖所示裝置進行了以下四個實驗,實驗開始先用酒精燈微熱3min,再加熱使之微微沸騰3min。實驗結束后充分振蕩試管Ⅱ再測有機層的厚度,實驗記錄如下:
| 實驗 編號 | 試管Ⅰ中的試劑 | 試管Ⅱ中試劑 | 測得有機層的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L濃硫酸 | 飽和碳酸鈉溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、鹽酸 | 1.2 |

①實驗D的目的是與實驗C相對照,證明H+對酯化反應具有催化作用。實驗D中應加入鹽酸的體積和濃度分別是 mL和 mol/L。
②分析實驗 (填實驗編號)的數據,可以推測出濃硫酸的吸水性提高了乙酸乙酯的產率。濃硫酸的吸水性能夠提高乙酸乙酯產率的原因是 。
③加熱有利于提高乙酸乙酯的產率,但實驗發現溫度過高乙酸乙酯的產率反而降低,可能的原因是 。
查看答案和解析>>
科目: 來源: 題型:
(1)3.4克NH3含質子的物質的量為 ,該氣體在標準狀況下的體積是 。
(2)已知500mL Al2(SO4)3溶液中含有Al3+為0.5mol,則Al2(SO4)3溶液的物質的量濃度為 mol/L,取上述溶液50mL加水到150mL,此溶液中SO42-的物質的量濃度為 mol/L。
查看答案和解析>>
科目: 來源: 題型:
已知氣體的摩爾質量越小,擴散速度越快。下圖所示為氣體擴散速度的實驗,兩種氣體擴散相遇時形成白色煙環。下列關于甲、乙的判斷正確的是
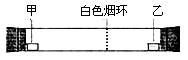
A.甲是濃氨水,乙是濃硫酸 B.甲是濃鹽酸,乙是濃氨水
C.甲是濃氨水,乙是濃鹽酸 D.甲是濃硝酸,乙是濃氨水
查看答案和解析>>
科目: 來源: 題型:
下表為元素周期表的一部分,請參照①~⑩在表中的位置,用化學用語回答下列問題:

(1)元素③形成的單質的電子式為 ;元素②形成的最高價氧化物的結構式為 。
(2)⑥、⑦兩元素的最高價氧化物的水化物之間反應的離子方程式為 。
(3)②、③、④、⑤元素形成的氫化物中,熱穩定性最強的是 (填化學式),沸點最高的是 (填化學式)。
(4)⑧、⑨元素的最高價氧化物的水化物酸性強弱比較 > (填化學式)。
(5)用電子式表示⑥、⑧兩元素結合成化合物的形成過程 。
(6)元素⑩在周期表中的位置 ;該元素的單質主要用途 (填一種)。
查看答案和解析>>
科目: 來源: 題型:
下列關于能源及能量轉化的說法,正確的是
A.以燃煤為主的“火力發電”是將化學能直接轉化為電能
B.燃料電池的能量轉化率可以達到100%
C.電池充電是將電能轉化為化學能的過程
D.氫氣在氧氣中燃燒,化學能全部轉化為熱能
查看答案和解析>>
科目: 來源: 題型:
工業制硫酸中的一步重要反應是SO2在400-600 ℃下的催化氧化:
2SO2+O2 ![]() 2SO3,這是一個正反應放熱的可逆反應。如果反應在密閉容器中進行,下述有關說法中錯誤的是
2SO3,這是一個正反應放熱的可逆反應。如果反應在密閉容器中進行,下述有關說法中錯誤的是
A?使用催化劑是為了加快反應速率,提高生產效率
B?在上述條件下,SO2不可能100%地轉化為SO3
C?為了提高SO2的轉化率,應適當提高O2的濃度
D?達到平衡時,SO2的濃度與SO3的濃度相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com