
科目: 來源: 題型:
A、B、C、D、E分別為(NH4)2SO4、NH4Cl、NaCl、Na2SO4、Ba(OH)2五種溶液中的某一種,把它們兩兩混合:
(1)A和B混合產生白色沉淀,加熱后無明顯變化;
(2)B和C混合產生白色沉淀,加熱后產生使濕潤紅色石蕊試紙變藍的氣體;
(3)B和E混合無明顯變化,加熱后產生使濕潤紅色石蕊試紙變藍的氣體。
根據以上現象,判斷A、B、C、D、E各為什么物質:
A , B ,C ,D E 。
查看答案和解析>>
科目: 來源: 題型:
利用化學原理可以對工廠排放的廢水進行有效檢測與合理處理。
⑴染料工業排放的廢水中含有大量有毒的NO2-,可在堿性條件下加入鋁粉除去(加熱處理后的廢水會產生能使濕潤的紅色石蕊試紙變藍的氣體)。除去NO2-的離子方程式為 ▲ 。
⑵廢水中的N、P元素是造成水體富營養化的關鍵因素,農藥廠排放的廢水中常含有較多的NH4+和PO43-,一般可以通過兩種方法將其除去。
①方法一:將Ca(OH)2或CaO 投加到待處理的廢水中,生成磷酸鈣,從而進行回收。當處理后的廢水中c(Ca2+)=2×10-7 mol/L時,溶液中c(PO43-)= ▲ mol/L。
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在廢水中加入鎂礦工業廢水,就可以生成高品位的磷礦石―鳥糞石,反應的方程式為Mg2++NH4++PO43-=MgNH4PO4↓。該方法中需要控制污水的pH為7.5~10,若pH高于10.7,鳥糞石的產量會大大降低。其原因可能為 ▲ 。與方法一相比,方法二的優點為 ▲ 。
⑶三氯乙烯在印刷、紡織等行業應用廣泛,為了減少其對環境的影響,可將三氯乙烯在二氧化鈦薄膜上催化降解,其反應的機理如下:
CCl2=CHCl +·Cl→·CCl2CHCl2
·CCl2CHCl2 + O2→·OOCCl2CHCl2
·OOCCl2CHCl2→·OCCl2CHCl2 + 1/2O2
·OCCl2CHCl2→CHCl2COCl +·Cl
該反應的總化學反應為 ▲ 。
查看答案和解析>>
科目: 來源: 題型:
在一定溫度下,將2mol A和2mol B兩種氣體相混合于體積為
2 L的某密閉容器中(容積不變),發生如下反應:3A(g)+B(g)![]() x C(g)+2D(g)
x C(g)+2D(g) ![]() H <0, 2min末反應達到平衡狀態(溫度不變),生成了0.8 mol D,并測得C的濃度為0.4 mol/L,請填寫下列空白:
H <0, 2min末反應達到平衡狀態(溫度不變),生成了0.8 mol D,并測得C的濃度為0.4 mol/L,請填寫下列空白:
(1)X的值等于 。
(2)計算該反應的化學平衡常數K= ,升高溫度時K值
將 (選填“增大”、“減小”、“不變”)。
(3)A的物質的轉化率為 。
(4)若維持溫度不變,在原平衡混合物的容器中再充入3mol C和3mol D,欲使達到新的平衡時,各物質的物質的量分數與原平衡相同,則至少應再充入B的物質的量為 mol;達新平衡時,A的物質的量為n(A)= mol。
查看答案和解析>>
科目: 來源: 題型:
X、Y、Z、M代表四種金屬元素,金屬X和Z用導線連接放入稀硫酸中時,X溶解,Z極上有氫氣放出;若用惰性電極電解Y2+和Z2+共存的溶液時,Y先析出;又知M+X2+ ![]() M2++X。則這四種金屬的活動性由強到弱的順序為 ( )
M2++X。則這四種金屬的活動性由強到弱的順序為 ( )
A.X>Z>Y>M B.M >X> Z > Y C.M>Z>X>Y D.X>Z>M>Y
查看答案和解析>>
科目: 來源: 題型:
某教師在課堂上用如圖所示的裝置來驗證濃硫酸與銅是否發生反應,并探討反應所產生氣體的性質。請回答下列問題:
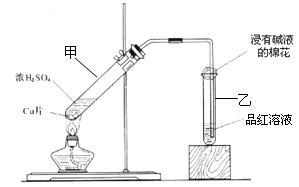
(1)試管乙中發生的現象是
該現象還能說明產生的氣體具有 性。
(2)寫出試管甲中所發生反應的化學方程式,并標明電子轉移方向和數目。
。
(3)試管乙口部浸有堿液的棉花的作用是 ,此防范措施也說明產生的氣體是 (填“酸性”、“中性”或“堿性”)氣體, (填“有”或“無”)毒性。
(4)SO2的排放是造成酸雨的主要因素,某同學通過實驗探究,得出酸雨pH隨時間的增加而減小的結論。為進一步研究酸雨的成分,該同學取某一時段的這種雨水V L,加入0.5 mol/L的Ba(OH)2溶液至不再產生沉淀時,恰好消耗40.00 mL Ba(OH)2溶液。請計算:
①該雨水中共溶解SO2的體積是 mL(標準狀況)。
②若生成沉淀物的質量為4.50 g,則沉淀物的組成為 (填寫化學式)。
查看答案和解析>>
科目: 來源: 題型:
下列有關Na2CO3和NaHCO3性質的說法中,正確的是
A.熱穩定性:Na2CO3<NaHCO3
B.相同溫度下,在水中Na2CO3的溶解度小于NaHCO3
C.106gNa2CO3和84gNaHCO3分別與過量鹽酸反應,放出CO2質量:Na2CO3>NaHCO3
D.Na2CO3 和NaHCO3均可與澄清石灰水反應
查看答案和解析>>
科目: 來源: 題型:
北京市場銷售的某種食用精制鹽包裝袋上有如下說明:
| 產品標準 | GB54 |
| 產品等級 | 一級 |
| 配 料 | 食鹽、碘酸鉀、抗結劑 |
| 碘含量(以I計) | 20~50mg/kg |
| 分裝時期 | |
| 分裝企業 |
(1)碘酸鉀與碘化鉀在酸性條件下發生如下反應,配平化學方程式(將化學計量數填于空白處)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反應生成的I2可用四氯化碳檢驗。向碘的四氯化碳溶液中加入Na2SO3稀溶液,將I2還原,以回收四氯化碳。
①Na2SO3稀溶液與I2反應的離子方![]() 程式是 。
程式是 。
②![]() 某學生設計回收四氯化碳的操作步驟為:
某學生設計回收四氯化碳的操作步驟為:
a.將碘的四氯化碳溶液置于分液漏斗中;
b.加入適量Na2SO3稀溶液;
c.分離出下層液體。
以上設計中遺漏的操作及在上述步驟中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某學生測定食用精制鹽的碘含量,其步驟為:
a. 準確稱取Wg食鹽,加適量蒸餾水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3與KI反應完全;
c.以淀粉為指示劑,逐滴加入物質的量濃度為2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反應完全。
①判斷c中反應恰好完全依據的現象是 。
②b中反應所產生的I2的物質的量是 mol。
③根據以上實驗和包裝袋說明,所測精制鹽的碘含量是 mg/kg。(以含w的代數式表示)
查看答案和解析>>
科目: 來源: 題型:
一定條件下,碘單質與砹單質以等物質的量進行反應,可得AtI。它與Zn、NH3都能發生反應,化學方程式分別如下:AtI+2Zn==ZnI2+ZnAt2 , AtI+2NH3(1)==NH4I+NH2At 。則下列敘述正確的是
A.ZnI2既是氧化產物,又是還原產物
B.ZnAt2既是氧化產物,又是還原產物
C.AtI與液氨反應,AtI既是氧化劑又是還原劑
D.AtI與液氨反應,是自身氧化還原反應
查看答案和解析>>
科目: 來源: 題型:
美日三名化學家[理查德·赫克(Richard Heck,美)、根岸榮—(Ei – ich Negishi,日)、鈴木章(Akira Suzuki,日)利用鈀(Pd)作催化劑,將有機化合物進行“裁剪”、“縫合”,創造出具有特殊功能的新物質而榮獲2010年諾貝爾化學獎。赫克反應(Heck反應)的通式可表示為(R – X中的R通常是不飽和烴基或苯環;R′CH=CH通常是丙烯酸酯或丙烯腈等):
![]()
現有A、B、C、D等有機化合物有如下轉化關系:

請回答下列問題:
(1)反應I的化學方程式為 。
(2)已知腈基(—C≡N)也具有不飽和性(可催化加氫),寫出CH2=CH—CN完全催化加氫的化學方程式: 。
(3)丙烯腈(CH2=CH—CN)可發生加聚反應生成一種高聚物,此高聚物的結構簡式為
。
(4)寫出B轉化為C的化學方程式: 。
(5)D的結構簡式為 。
(6)D具有化學性質有(填編號) 。
A.加熱能與氫氧化鈉溶液反應
B.能使溴的四氯化碳溶液褪色
C.能發生縮聚反應和加聚反應
D.能使酸性高錳酸鉀溶液褪色
(7)已知:醛基直接與苯環連接的醛如![]() 不能被新制的氫氧化銅氧化。寫出同時符合下列條件的D的同分異構體的結構簡式: 。
不能被新制的氫氧化銅氧化。寫出同時符合下列條件的D的同分異構體的結構簡式: 。
①波譜分析顯示分子中沒有甲基;
②1,3,5—三取代苯;
③具有酸性,既能與Fe3+作用顯色,又能使溴水褪色,易被新制的氫氧化銅氧化
查看答案和解析>>
科目: 來源: 題型:
下列說法正確的是( )
A. 鈉保存在煤油里的原因之一是它極易與氧氣反應
B. 鋁在空氣中很容易燃燒
C. 鎂表面的氧化膜疏松,不能保護內層金屬
D. 鐵銹的主要成分是Fe3O4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com