
科目: 來源: 題型:
(17分)將羧酸的堿金屬鹽電解可得到烴類化合物。例如:
2CH3COOK+2H2O![]() CH3-CH3+2CO2↑+H2↑+2KOH
CH3-CH3+2CO2↑+H2↑+2KOH
 請根據下列表示的衍變關系,回答問題。
請根據下列表示的衍變關系,回答問題。
(1)寫出下列物質的結構簡式A: E: I
(2)G能發生反應的類型有(填序號):
a.取代 b.加成 c.還原 d.氧化 e.消去 f.水解
(3)寫出H的最簡單的兩種同系物的結構簡式 , 。
(4)F與J的關系為 (填序號) a.同一物質 b.同系物 c.同分異構體 d.同素異形體
(5)寫出下列過程的化學方程式:
C→D: C+E→F
查看答案和解析>>
科目: 來源: 題型:
(10分)A、B、C、D、E是位于短周期的主族元素,其中A、B為金屬元素。已知:①熱穩定性:HmD>HmC;②Cm-、E(m-1)-具有相同的電子層結構;③B與E在同一周期,在該周期中,E的原子半徑最小,B的離子半徑最小;④A、B所形成的單核離子具有相同的電子層結構,B的最高價氧化物對應的水化物與A、E的最高價氧化物對應的水化物都能反應。依據上述信息回答下列問題:
(1)HmD的電子式:___________________。
(2)Cm-、E(m-1)-的還原性強弱為___________>___________(填離子符號),能證明其
還原性強弱的離子方程式為 。
(3)寫出B的最高價氧化物對應的水化物和A的最高價氧化物對應的水化物反應的離子方程式_________________________________________________________。
(4)在B、C、E單質中,符合下列轉化關系的是___________。(填元素符號)
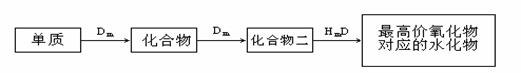
查看答案和解析>>
科目: 來源: 題型:
(6分)有下列轉化關系: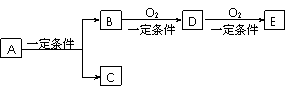
(1)若C是可用于自來水消毒的氣體,A生成的B的反應為工業上冶煉金屬B的反應,反應條件為電解,D、E是氧化物,D轉化為E時增加氧的質量是總質量的25.8%,則寫出A在一定條件下生成的C方程式 , E的電子式為
(2)若E是酸酐,且為無色易揮發的晶體,A為氣態氫化物,則A與D反應生成B的化學方程式為 。
查看答案和解析>>
科目: 來源: 題型:
(6分)填空:
(1)在測定硫酸銅結晶水含量實驗過程中,稱量操作至少進行 次。當加熱到
時,停止加熱,并將坩堝放在 中冷卻。當 時則可認為結晶水已經完全失去。實際操作中,有些操作會使實驗結果偏高或偏低。下列操作會使測定結果偏高的是 (填字母)
A.加熱溫度過高而使硫酸銅部分分解 B.坩堝用水洗后沒有烘干
C.加熱后放在空氣中冷卻 D.粉末未完全變白就停止加熱
(2)同素異形體相互轉化的反應熱相當小而且轉化速度較慢,有時還很不完全,測定反應熱很困難。現在可根據蓋斯提出的觀點“不管化學過程是一步完成或分幾步完成,這個總過程的熱效應是相同的”來研究。已知: P4(s、白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ·mol-1
P(s、紅磷)+5/4O2(g)=1/4P4O10(s);△H=-738.5kJ·mol-1
由此可知白磷的穩定性比紅磷_____。(填寫“強”或“弱”)
查看答案和解析>>
科目: 來源: 題型:
下列敘述正確的是 ( )
A.在原電池的負極和電解池的陰極上都是發生氧化反應
B.鋁比鐵活潑,但鋁制品比鐵制品在空氣中耐腐蝕
C.用惰性電極電解飽和NaCl溶液,若有2mol電子轉移,則生成1molNaOH
D.用惰性電極電解Na2SO4溶液,陰陽兩極產物的物質的量之比為1:2
查看答案和解析>>
科目: 來源: 題型:
如下圖所示,X、Y、Q、W都是惰性電極,將電源接通后,W極附近顏色逐漸加深。下列說法中不正確的是( )
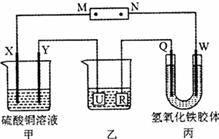
A.電源的M極為正極
B.甲裝置中溶液的PH減小
C.甲裝置的兩個電極上都有單質生成且物質的量之比為1:1
D.欲用乙裝置給銅鍍銀,U極應該是Ag,電鍍液選擇AgNO3溶液
查看答案和解析>>
科目: 來源: 題型:
設NA表示阿伏加德羅常數,下列說法中正確的是( )
A.1mol甲基正離子(CH3+)所含電子數為8NA
B.NA個H2分子的質量約為2g,它所占的體積約為22.4L
C.標準狀況下,11.2LCHCl3中所含的分子數為0.5NA
D.500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的數目為0.5NA
查看答案和解析>>
科目: 來源: 題型:
下列“黃色”不屬于因化學反應而產生的是( )
A.硫置于水中,沉淀物質呈黃色 B.久置的碘化鉀溶液呈黃色
C.久置的濃硝酸呈黃色 D.雞蛋白溶液遇濃硝酸呈黃色
查看答案和解析>>
科目: 來源: 題型:
用CH4催化還原NOx可以消除氮氧化物的污染。已知:
①![]()
②![]()
③![]()
下列說法不正確的是 ( )
A.等物質的量的CH4參加反應,反應①②轉移的電子數相同
B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);⊿H=-618KJ/mol
C.0.2 mol CH4還原NO2至N2,且生成H2O(g)放出的熱量為173.4kJ
D.若用4.48 L(標準狀況)CH4還原NO2至N2,整個過程中轉移電子1.60mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com